Гомогенді жүйелер және қайтымды реакциялар: массалар заңы, Оствальдтың сұйылту заңы және химиялық кинетика



Тақырыбы:
Гомогенді жүйелер. Қайтымды реакцияларға әрекеттесушi
массалар заңын қолдану
.
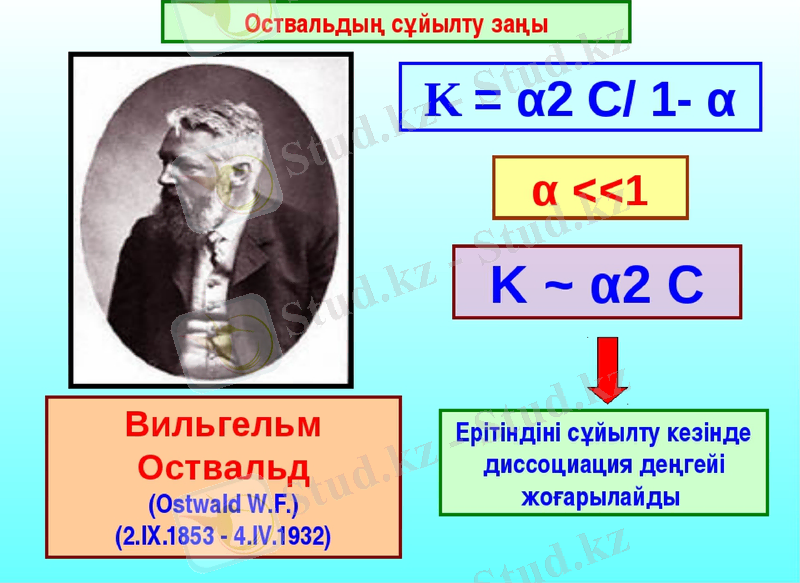
Оствальдтың сұйылту заңы
Орындаған:Рахматіллаева Ажар

Химиялық реакциялардың жүру заңдылықтары
Химиялық кинетика - реакцияның жүру механизімін, жылдамдығын және жылдамдықта әрекеттесетін заттардың концентрацияларының, температураның, қысымның, катализаторлардың әсерлерін зерттейтін химияның бөлімі.
Химиялық кинетика
Реакцияның жүру механизмі
Реакция жылдамдығы
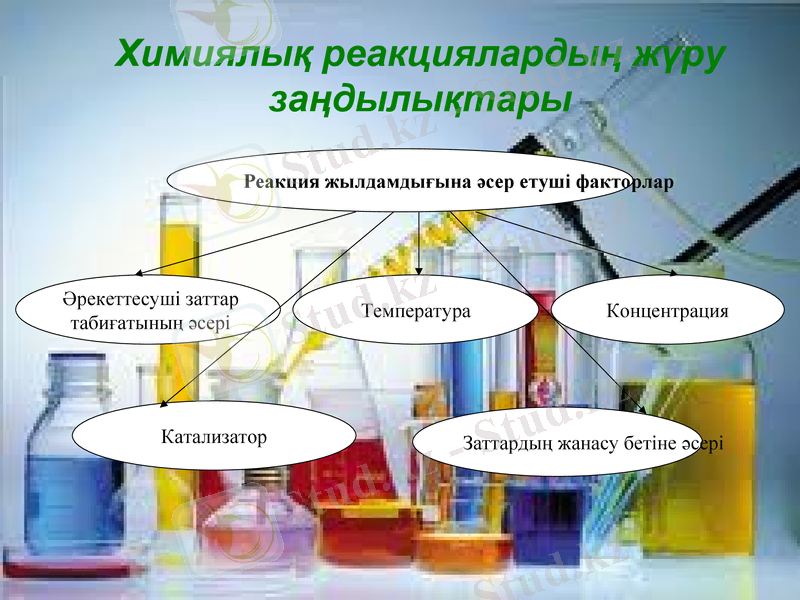
Реакция жылдамдығына әсер етуші факторлар

Химиялық реакциялардың жүру заңдылықтары
Химиялық реакцияның жылдамдығы деп - уақыт бірлігінде әрекеттесетін заттардың немесе реакция өнімдерінің біреуінің концентрацияларының өзгеруін айтады.
Реакция жылдамдығы
Гомогенді реакция жылдамдығы деп - жүйенің белгілі бір көлемінде уақыт бірлігі ішінде реакцияға қатысқан немесе реакция кезінде түзілген заттың мөлшерін айтады:
Vгом = ±
Гетерогенді реакцияның жылдамдығы деп - фаза бетінің аудан бірлігінде белгілі бір уақыт ішінде реакцияға қатысатын немесе реакция кезінде түзілетін заттың мөлшерін айтады:
Vгетерог = ±

Химиялық реакциялардың жүру заңдылықтары
Реакция жылдамдығы
Орташа жылдамдық:
А+В=С+Д теңдеуі бойынша өтетін реакцияның жылдамдығын жалпы түрде қарастырайық. А заты жұмсалған сайын реакция жылдамдығы кемиді. (1сурет), А затының концентрациясы белгілі бір t1уақыт кезеңінде с1шамасымен өлшенеді, ал t2 кезеңінде с2 - ге тең, сонда ∆t = t2 - t1 уақыт аралығында заттардың концентрациясының өзгеруі ∆с = с2 - с1 құрайды, осыдан реакцияның орташа жылдамдығы (ν) мынаған тең:
«минус» белгісі А затының концентрациясы кемігеніне сай, яғни с2 - с1 айырмасы теріс мәнді болғанда қойылады, өйткені реакция жылдамдығы тек оң шамалы болады.
Лездік жылдамдық:
Берілген уақыттағы (сол сәттегі) реакция жылдамдығын лездік (шын, нағыз) жылдамдық
дейді, ол тең:
Реакция жылдамдығы әркез оң мәнде қабылданады, сондықтан әуелгі концентрациялар туындысы «минус» белгісімен, ал реакция өнімі «плюс» белгісімен алынады.
Химиялық реакциялардың жүру заңдылықтары
Реакция жылдамдығына әсер етуші факторлар
Әрекеттесуші заттар
табиғатының әсері
Температура
Концентрация
Катализатор
Заттардың жанасу бетіне әсері

1 Әр түрлі фазадан тұратын жүйе:
А) гетерогенді В) жанасу беті
С) гомогенді Д) лимиттеуші саты
2. Гомогенді реакцияға мысал келтір:
А) С(қ) + О2(г) ↔ СО2(г) В) 2NО(г) + О2(г) ↔ 2NО2(г)
С) 4Fe(қ) + 3О2(г) →2Fe2O3 Д) 4Al(қ) + О2(г) ↔ 2Al2O3
3. Әрекеттесуші және түзілетін заттар бірдей агрегаттық күйде болатын реакция:
А) гетерогенді В) қайтымды
С) гомогенді Д) қайтымсыз
4. Әрекеттесуші және үзілетін заттар әртүрлі агрегаттық күйде болатын реакция:
А) гетерогенді В) қайтымды
С) гомогенді Д) қайтымсыз
5. Гетерогенді реакцияға мысал келтір:
А) Н2(г) + J2(г) →2НJ(г) В) 2NО(г) + О2(г) ↔ 2NО2(г)
С) 4Fe(қ) + 3О2(г) →2Fe2O3 Д) 2СО(г) + О2(г) ↔ 2СО2(г)
Тест сурактары


Назар салып, тыңдағандарыңызға көп рахмет
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz