Кристалл құрылымдарының классификациясы және силикаттардың SiO4 тетраэдрлік құрылымдық типтері



Топтың аксиомалар кестесі. Топтық қасиеттер
Қабылдаған: Қатпаева Қ.
Орындаған: Тұтқабай Д.
Тобы: ЖФЗ-711

ЖОСПАР
1) Қабатты құрылым.
2) Қаңқалы құрылым.
3) Силикаттың құрылымдары.

Кристаллдың геометриялық моделінде кристалл бірліктерінің (атомдардың немесе молекулалардың) кеңістікте орналасуы, олардың ара қашықтығы және олардың әр қайсысын қоршаған атомдар саны (координациялық сан) қарастырылады. Кристаллдың геометриялық моделі, кристаллдың жеңілдетілген физикалық модельдің шегі болып есептеледі. Бұл модель арқылы көрнекті және қарапайым формада кристаллдарды сипаттауға және бірнеше жалпы заңдылықтарын айтуға (жазуға) болады.


Кристаллдың көрінісін (изображение) немесе құрылым моделін үш әдіспен жасауға болады: а) шарлардың ауырлық центрін беретін нүктелер жүйесімен, бірақ бұл кеңістікті толтыратын дәрежесі жөнінде мәлімет бермейді; б) координациялық полиэдрмен; в) катиондар және аниондар өлшемдеріне сәйкес келетін шарларды тығыз орналастыру арқылы. Бұл әдіс ыңғайсыз, себебі мұнда біз тек шарлардың бір бөлігін ғана көре аламыз.

Белгілі америка кристаллографы Л. Полинг координациялық полиэдр (көпжақты) тәсілін ұсынды. Бұл тәсілді күрделі құрылымнан құралған кристалл құрылымын айқындау үшін белгілі ғалым, академик Н. Б. Белов қолданды. Ол катионды полиэдрдің формасын анықтады және жиі кездеспейтін координациялық санға ие көптеген күрделі құрылымдардың моделін жасады; көптеген күрделі құрылымдарды анықтай білді, соның ішінде силикаттардың да құрылымдарын да анықтады.

Полинг-Белов тәсілінің негізгі идеясы көптеген құрылымды топтар бірлігін бір геометриялық «блок»-қа жинақтау болып табылады, яғни координациялық полиэдрге жинақтау. Координациялық полиэдр катионды қоршаған аниондар центрін (орталығын) тура сызықпен қосқанда пайда болады; полиэдр шыңының саны катионның координациялық санына тең. Екі тығыз орналасуда координациялық сан 6 және 4-ке тең, сәйкесінше октаэдрлер мен тетраэдрлер болады (85-сурет) .
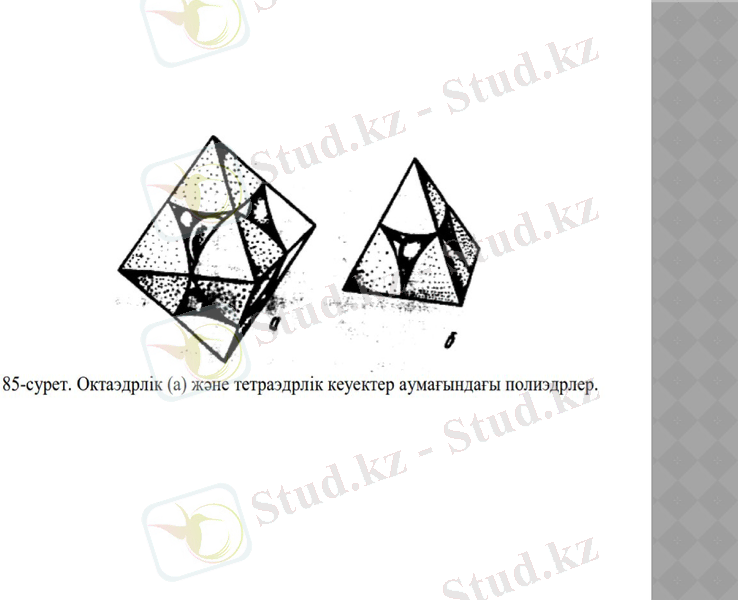

Кристалл құрылымының элементар ұяшығынан координациялық көпжақтының айырмашылығы жалпы жағдайда құрылым егелейтін көлем барлық көлемді толтырмайды, тек шартты түрде көлемнің толтырылған бөлігін толтырылмаған бөлігімен шектейді. Координациялық полиэдрлер бірбірінен шыңы арқылы немесе қабырғасы (жағы) арқылы бөлінеді, сонымен бір-бірімен байланысқан кеңістіктегі конфигурация пайда болады. Бұл конфигурация кристалл құрылымына эквивалентті.

Тығыз емес құрылымдағы координациялық тетраэдрлер бір-бірімен қосылмаған жерлері А1 және А2 торларға қарағанда тығыздығы төмен. Геометриялық деңгейде құрылымдық бірлік атомдар болып есептеледі. Бірақ көп жағдайда кристалл пайда болардан бұрын немесе кристалл пайда болу процессі барысында атомдар өздерінің химиялық табиғатына байланысты белгілі тұрақты топтарға қосылады, бұл топтар кристаллда сақталады. Сондықтан олар кристаллдың құрылымдық бірлігі болып қарастырылады. Барлық кристаллдар құрылымын топтардың жоқтығына немесе құрылымдық топтардың барлығына (топтың ішінде күштірек байланыс болады, олай болса олар топтар арасындағы байланысқа қарағанда қысқа, жақыннан әсерлесетін күш болады) және топтардың өлшемдеріне, яғни оларды шектейтін өлшем сандарына байланысты классификациялауға (бөлуге) болады. Қазіргі кезде кристалл құрылымдарын 5 типке бөлуге болады: 1) координациялық, 2) аралды, 3) тізбектелген және ленталы, 4) қабатты, 5) қаңқалы.

1. Координациялық құрылымның атомдары немесе иондары жоғары координациялық санға ие (12, 6+8, 8+6) . Координациялық сан идеал координациялық полиэдрге (октаэдр, кубооктаэдр) сәйкес келеді (85-суретке қара) . Мұндай құрылымға барлық металлдар және олардың қоспалары, иондық және коваленттік қосындылардың көпшілігі, сонымен қатар қатты күйге айналған құнды газдар ие.
2. Аралды құрылымның құрылымдық бірлігі атом болған координациялық құрылымнан айырмашылығы, мұнда құрылым бірлігі екі және одан да көп атомдардан тұрады (86- сурет) .


Топтардың ішіндегі атомдар арасындағы байланыс күшті, ал әр топтаға жататын атомдар арасындағы байланыс әлсіз. Топтар ішіндегі атомдардың конфигурациясы (орналасуы) топтардың өзара орналасуына аса тәуелді емес, яғни топтарды кристалл құрылымының тұрақты бірлігі деп есептеуге болады, сондықтан да аралды деп аталады.
Аралды құрылымға тұрақталған молекулалық қосндылар жатады. Олар органикалық немесе органикалық емес лигандалы шектелген металлдар комплекстік (топтық) құрылымға ие. Мысалы, пирит -FeS2, барит - BaSO4, оливин (Mg, Fe) 2(SiO4), т. б.
Арал құрылымы түрлеріне сақиналық құрылым жатады, мұндай құрылымға көптеген минералдардың құрылымы жатады, мысалы сераның, бірнеше силикаттардың құрылымдары.
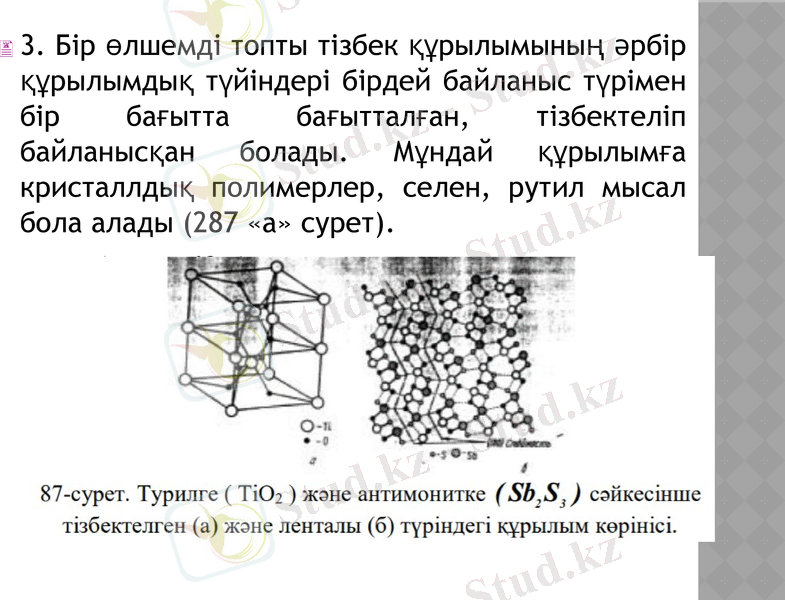
3. Бір өлшемді топты тізбек құрылымының әрбір құрылымдық түйіндері бірдей байланыс түрімен бір бағытта бағытталған, тізбектеліп байланысқан болады. Мұндай құрылымға кристаллдық полимерлер, селен, рутил мысал бола алады (287 «а» сурет) .

Егер бұл тізбек симметрия жазықтығында шағылысу арқылы екіленсе, онда ленталы құрылым пайда болады (Sb2S3 - антимонит, HF2O2 - гетит және т. б. ) (87 «б» сурет) .

4. Қабаттық құрылым күшті байланыспен байланған екі өлшемді шексізге таралған атом топтарынан тұратын құрылымды қабаттық құрылым болып есептеледі. Мұндай құрылымға графит - C, ковеллин - CuS, қабатты силикаттар мысал бола алады (88-сурет) .
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz