Атом, периодтық жүйе, иондар мен молекулалар: құрылымы мен негізгі қасиеттері




Атом (көне грекше: ἄτομος - Химиялық элементтерді құрайтын, олардың өзіне тән ерекшеліктерін сақтайтын ең кішкене бөлшек.
Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 104 -105 есе кіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады.

Периодтық жүйе периодтық заңның құрылымдық кескіні. Ол 7 периодтан 8 топтан тұратын кесте. Периодтар үлкен және кіші болып бөлінеді. Алғашқы үш период кіші периодтар, олар бір қатардан ғана тұрады, ал үлкен периодтар екі қатардан тұрады.
Бір периодта орналасқан элементтердің энергетикалық деңгейлерінің саны бірдей болғанымен, олардың ядро зарядтарының артуына байланысты ядроның электронды тарту күші артады, сондықтан атом радиустары солдан оңға карай кемиді.
Периодтарда солдан оңға қарай сыртқы қабаттағы электрондар саны біртіндеп артады, бұл металдық қасиеттің біртіндеп әлсіреп, бейметалдық қасиеттің артуына әкеп соғады.

Атом өзінің сыртқы бір немесе бірнеше электрондарын жоғалтқанда оң, ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық өлшемдері ~ 10-8 см, көлденең қимасының ауданы ~10-16 см2, көлемі ~10-24 см3. Борлық атом теориясында ең қарапайым атом - сутегі атомы. Оның радиусының дәл белгілі бір мәні бар және ол мүмкін болатын ең кіші айналу орбитасының радиусы шамасына тең: a=0. 53 * 10−8 см (дәлірек, 0. 52917*10-8 см) . Атомның массасы, негізінен оның ядросының массасына тең және ол массалық санға (А), яғни протондар мен нейтрондардың жалпы санына (нуклондардың жалпы санына) пропорционал болып ұлғаяды.

Атом өте ұсақ бөлшек болғандықтан, ондағы электронның қозғалысы микродүниенің қозғалу заңдылықтарына бағынады. Электрондар ядро сыртындағы кеңістікті біртіндеп толтырады, электрондардың орналасу заңдылықтарын білу элементтің физикалық және химиялық қасиеттерін анықтау үшін қажет. Электрон ядроны одан белгілі бір қашықтықта (энергия қорының шамасына қарай) айналып жүру мүмкіндігі ең жоғары кеңістіктің бөлігі орбиталь - электрондық бұлт деп аталады. Қозғалыстағы электрон бұлтының пішіні әр түрлі болады: шар тәрізді, олар s әрпімен белгіленеді. р-электрондар гантель тәрізді, олардан басқа d - деңгейшелері де болады.

Атомдардың құрылысын түсіндіру үшін барлық элементтердің периодтық системасын қарап шығу керек. Бұл мәселе химия курсында айтылады. Біз бұл жерде тек сол системаның қазіргі замандағы түрін түсіндіретін бір жеңіл схема келтіреміз (схеманы қараңыз) . Aтом ядросы оң зарядтыпротондардан және зарядсыз нейтрондардан тұрады дегенбіз. Ядро сыртында айналып жүретін жеңіл және теріс зарядты электрондар бар. Әрбір элементтің электрон саны оның рет нөміріне тең. Мысалы, сутегінің нөмірі 1, оның электроны да 1, уранның нөмірі 92, оның электроны да 92. Сол электрондар атом ядросының сыртында белгілі бір тәртіп бойынша орналасқан.

Ион (грек. іон - жүріп келе жатқан) - кристалдардың дербес бөлігі ретінде немесе ерітінді құрамында, кейде газ түрінде ұшырасатын он (катион) немесе теріс (анион) зарядталған атом (кешенді ион, яғни атомдар тобы) .
Иондар - атомдар немесе химиялық байланысқан атомдар тобы электрондарын жоғалтып немесе сырттан электрондар қосып алғанда пайда болатын электрлік зарядталған бөлшектер.

«Иондар» терминін 1834 ж. ағылшын физигі М. Фарадей (1791 - 1867) енгізген. Бөлшектерден электрондарды бөліп алу энергия шығынын қажет етеді, бұл энергия шығыны иондалу потенциалы деп аталады, ал электрондар қосылғанда энергия бөлінеді. Оң зарядты Индарды катиондар, ал теріс зарядты Иондарды аниондар деп атайды. Иондар газдарда молекулалардың (атомдардың) энергиясы жоғары бөлшектермен соқтығысуы кезінде (фотоиондалу кезінде), иондауыш сәулелер әсерінен не күшті электр өрісінің әсерінен, ал ерітінділерде еріген заттың диссоциациялануынан пайда болады. Сілтілік және сілтілік-жер металдары катиондарын биологиялық мембраналар арқылы тасымалдайтын органик. заттарды ионофорлар деп атайды. Ионофорлар биохимияда Иондардың тасымалдануын реттейді. Химияда Иондар экстракциялауда, мембраналық катализде, техникада электрод жасауда қолданылады.
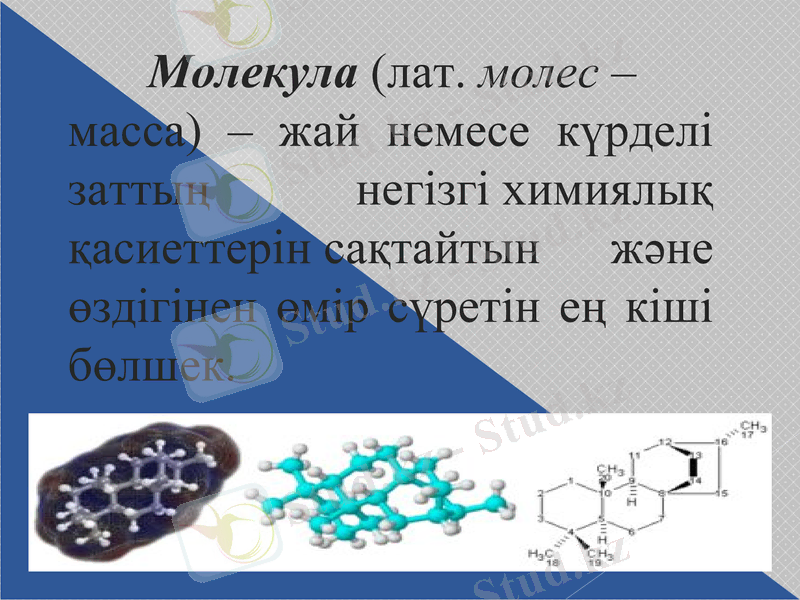
Молекула (лат. молес - масса) - жай немесе күрделі заттың негізгі химиялық қасиеттерін сақтайтын және өздігінен өмір сүретін ең кіші бөлшек.



- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz