Биологиялық жүйелердің термодинамикасы: бірінші және екінші заңдар, энтальпия мен энтропия



Биологиялық жүйелердің термодинамикасы

Жоспары:
Жүйе, энергия, жұмыс, ішкі энергия, энтальпия.
Термодинамиканың бірінші заңы. Биожүйелер үшін термодинамиканың бірінші заңы. Гесс заңы.
Термодинамиканың екінші заңы. Термодинамиканың екінші заңының биожүйелер үшін қолдану.
Пайдаланылған әдебиеттер.

Кіріспе.
Биофизика - тірі жүйелердегі физико-химиялық құбылыстарды және оның қоршаған ортамен байланысы туралы ғылым.
Биофизика - биологиялық жүйелердің әртүрлі деңгейлерінде жүретін физикалық және физико-химиялық процестер туралы ғылым
Биофизиканың зерттеу нысаны - тірі жүйе (клетка бөлшегі, клетка, мүше, мүшелер жүйесі, тұтас организм)

Ашық жүйелер күй заңдылықтарын ашып көрсету. Тіршіліктің термодинамикалық негізін теориялық тұрғыда түсіндіру.
Жеке және эволюциялық даму, өзін-өзі реттеу және өзін-өзі жаңарту құбылыстарын ғылыми тұрғыда түсіндіру.
Биополимерлер мен биологиялық активті заттардың құрылысы мен функционалды қасиеттері арасындағы байланысты анықтау.
Биообъектілерді зерттеудің физико-химиялық әдістерін жасау және теориялық негіздеу.
Функционалды процестер кешендеріне физикалық түсіндірме беру (нерв импульстарының генерациясы және таралуы, бұлшықет жиырылуы, рецепция және т. б. )
Биофизиканың міндеттері:


Термодинамика - әртүрлі энергиялардың айналымдарын сапалық және сандық сипаттаумен айналысатын физика ғылымының бір бөлімі.
Термодинамика - макроскопиялық материалдық жүйелердің ортақ қасиеттері, термодинамикалық тепе-теңдік және осы күйлердің арасында жүріп отыратын айналымдар туралы ілім.

Қазіргі таңда термодинамиканың екі негізгі бөлімі бар:
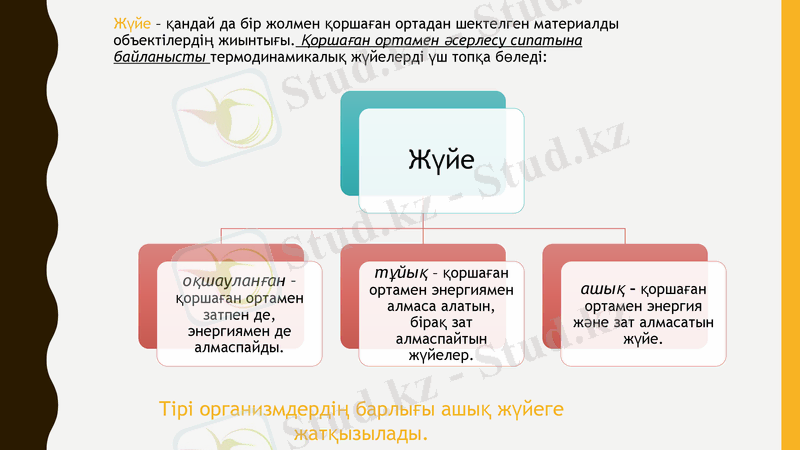
Жүйе - қандай да бір жолмен қоршаған ортадан шектелген материалды объектілердің жиынтығы. Қоршаған ортамен әсерлесу сипатына байланысты термодинамикалық жүйелерді үш топқа бөледі:
Тірі организмдердің барлығы ашық жүйеге жатқызылады.
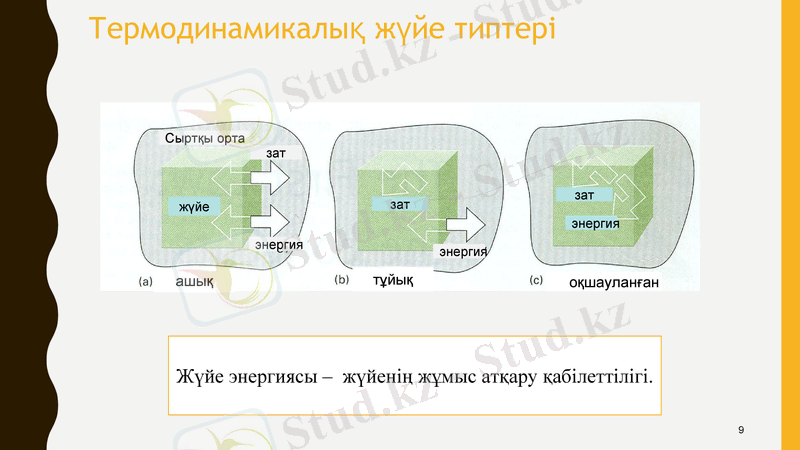
Термодинамикалық жүйе типтері
9
Жүйе энергиясы - жүйенің жұмыс атқару қабілеттілігі.
жүйе
зат
тұйық
оқшауланған
зат
энергия
Сыртқы орта
энергия
ашық
зат
энергия

Кез-келген термодинамикалық жүйе параметрлердің екі тобымен сипатталады:
Интенсивті термодинамикалық параметрлер
Экстенсивті термодинамикалық параметрлер
жалпы энергия, энтропия, ішкі энергия
жүйедегі бөлшектердің саны мен массасына тәуелді.
қысым, температура және т. б.
жүйедегі бөлшектердің саны мен массасына тәуелсіз.

100⁰ С
60⁰ С
11
Күй параметрлерінің уақытқа байланысты өзгеріссіз сақталуын термодинамикалық тепе-теңдік деп атайды.
Егер оқшауланған жүйе тепе-теңдік күйден шығарылса, онда ол тепе-теңдік күйге өздігінен ұмтылады.

Термодинамикалық процесс
Термодинамикалық жүйеде параметрлерлердің өзгеруін термодинамикалық процесс деп атайды.
Жүйе энергиясын (W) екі бөлшектін қосындысы ретінде қарастыруға болады: жүйенің қозғалысы мен орнына тәуелді - толық (Wт) және бұл факторларға тәуелсіз (U) .
W=Wт + U
U - жүйенің ішкі энергиясы.
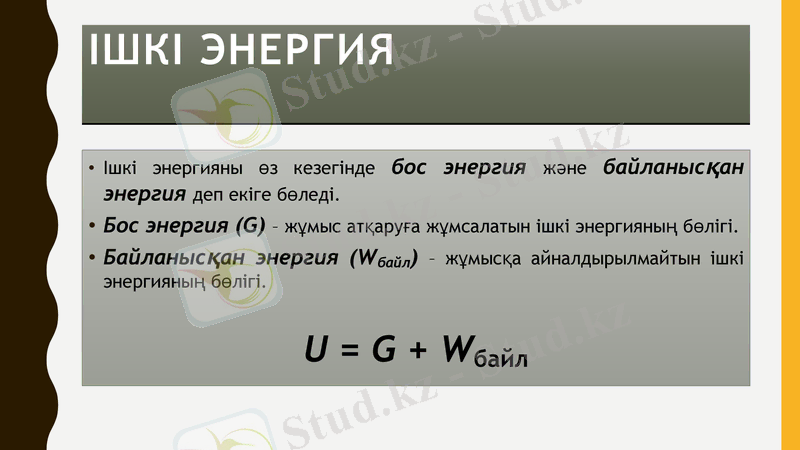
Ішкі энергия
Ішкі энергияны өз кезегінде бос энергия және байланысқан энергия деп екіге бөледі.
Бос энергия (G) - жұмыс атқаруға жұмсалатын ішкі энергияның бөлігі.
Байланысқан энергия (Wбайл) - жұмысқа айналдырылмайтын ішкі энергияның бөлігі.
U = G + Wбайл

Термодинамиканың бірінші заңы
Материалды жүйедегі энергияның жалпы суммасы жүйеде жүріп жатқан өзгерістерге тәуелсіз тұрақты сақталады.
Жүйедегі энергияның өзгерісі тек қана қоршаған ортамен энергия алмасу арқылы жүзеге асады.
Термодинамиканың бірінші заңы:
Энергияның сақталу заңы:
энергия жоқтан пайда болмайды және ешқайда жоғалмайды, ол тек бір түрден екінші түрге айналады.
Термодинамиканың бірінші заңы - энергияның сақталу заңының сандық көрінісі болып табылады.

Термодинамиканың бірінші заңы
Жүйенің ішкі энергиясының өзгерісі U жүйеге берілген жылудың Q алгебралық суммасы мен атқарылған жұмыстың A
қосындысына тең.
U= Q + A
Жүйеге берілген жылу мөлшері (Q) жүйенің ішкі энергиясын (U) өзгертуге және сыртқы күштерге қарсы жүйенің жұмыс (A) істеуіне жұмсалады:
Q = U + A
немесе

Жүйенің жылу эффектісі -
энтальпия (H, H, dH)
- қысым р тұрақты болған жағдайда жүйеге берілетін немесе одан алынатын жылу мөлшері :
H = U + pV
p және V тұрақты болған жағдайда, биохимиялық процестерде
H = U,
H және U - жүйенің күй функциясы.
Энтальпия калориямен өлшенеді:
1 кал 1 г суды 1оС-қа
немесе
1 кДж 1 г суды 0, 24оС-қа жылытады.

Термодинамиканың бірінші заңын биологиялық жүйелер үшін қолдану
Термодинамиканың бірінші заңын тірі жүйелер үшін қолдану мүмкіндігі туралы алғаш рет неміс физиологы, әрі гигиенист Макс Рубнер айтты.
Max Rubner
(1854-1932)

Термодинамиканың бірінші заңының биожүйелер үшін тұжырымдамасы
Тірі организмдерде жасалатын жұмыстың барлығы АТФ энергиясы есебінен атқарылады.
АТФ - әмбебаб энергия көзі:
АТФ + Н2О АДФ + Н3РО4 + 7, 0 - 8, 5 ккал
Темодинамиканың бірінші заңын
тірі организмдер үшін толықтай қолдануға болады.
Тірі жүйелер үшін
термодинамиканың бірінші заңы былай тұжырымдалады:
Тірі организмдердегі жұмыстың барлық түрі қоректік заттардың тотығуы кезінде бөлінетін энергияның эквивалетті мөлшері есебінен атқарылады.
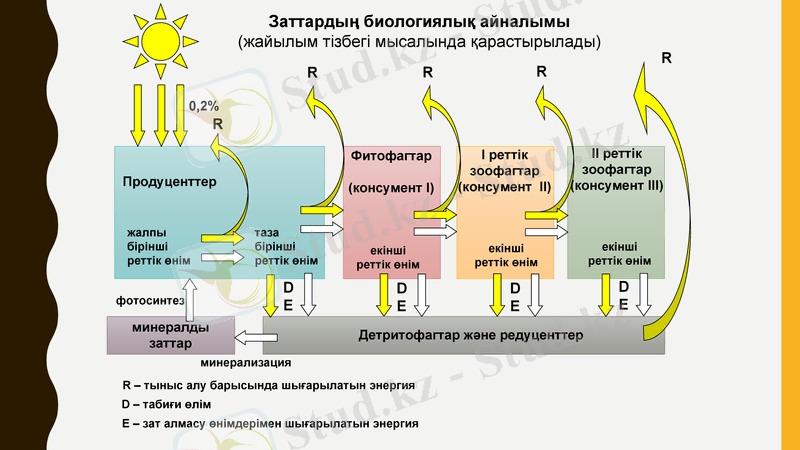
Продуценттер
І реттік зоофагтар (консумент II)
Фитофагтар
(консумент І)
ІІ реттік зоофагтар (консумент III)
екінші реттік өнім
екінші реттік өнім
екінші реттік өнім
жалпы бірінші реттік өнім
таза бірінші реттік өнім
Детритофагтар және редуценттер
минералды заттар
R
R
R
R
D
E
D
E
D
E
D
E
фотосинтез
минерализация
R - тыныс алу барысында шығарылатын энергия
D - табиғи өлім
E - зат алмасу өнімдерімен шығарылатын энергия
Заттардың биологиялық айналымы
(жайылым тізбегі мысалында қарастырылады)
R
0, 2%
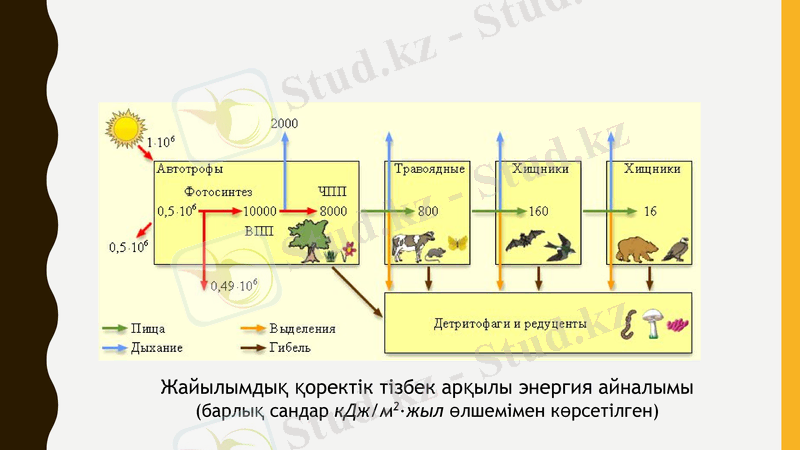
Жайылымдық қоректік тізбек арқылы энергия айналымы
(барлық сандар кДж/м2∙жыл өлшемімен көрсетілген)

Химиялық айналымдар кезінде термодинамиканың бірінші заңынан шығатын салдар: Гесс заңы.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz