Комплексті қосылыстар: құрылысы, байланыстың табиғаты, номенклатурасы, изомериясы және қолданылуы



Комплексті қосылыстар (КҚ)

Жоспар:
1. Комплексті қосылыстардың құрылысы. Вернердің координациялық теориясының негізгі қағидалары
2. КҚ химиялық байланыстың табиғаты
3. КҚ жіктелуі
4. КҚ номенклатурасы
5. КҚ тұрақтылығы
6. КҚ изомериясы
7. КҚ медицинада және фармацияда қолданылуы

КҚ құрылысы
Химиялық қосылыстар барлығы қарапайым немесе атомдық қосылыстар және комплексті немесе молекулалық қосылыстар деп екіге бөлінеді. Атомдық қосылыстарға жатады: оксидтер, негіздер, қышқылдар, жәй тұздар(иондық немесе атомдық байланысы бар)
Бұларды I-ші реттік қоспалар деп атайды.
II-ші реттік қоспаларға жататын күрделі коспалар (молекулалардан немесе иондардан құралады) . Олардың арасында координациялық немесе донорлы-акцепторлы байланысы болады.
Сондықтан: КҚ дегеніміз - бұл кристалды тордың түйіндерінде орналасатын күрделі бөлшектер (комплексті иондар), балқыған немесе еріген жағдайына ауысқан кезде өздерінің қалпын сақтайтын қосылыстар және құрамында бір донорлы-акцепторлы байланысы бар заттар.
Мысалы:
K[ Ag(CN) 2] ↔ K⁺ + [Ag(CN) 2] ⁻

КҚ химиялық байланыстың табиғаты Қазіргі кезде комплексті қосылыстарда байланыстың табиғатын қарастыратын үш теориялық әдісі бар:
Валенттік байланыс әдісі
Кристалдық өріс теориясы
Молекулалық орбитальдар әдісі
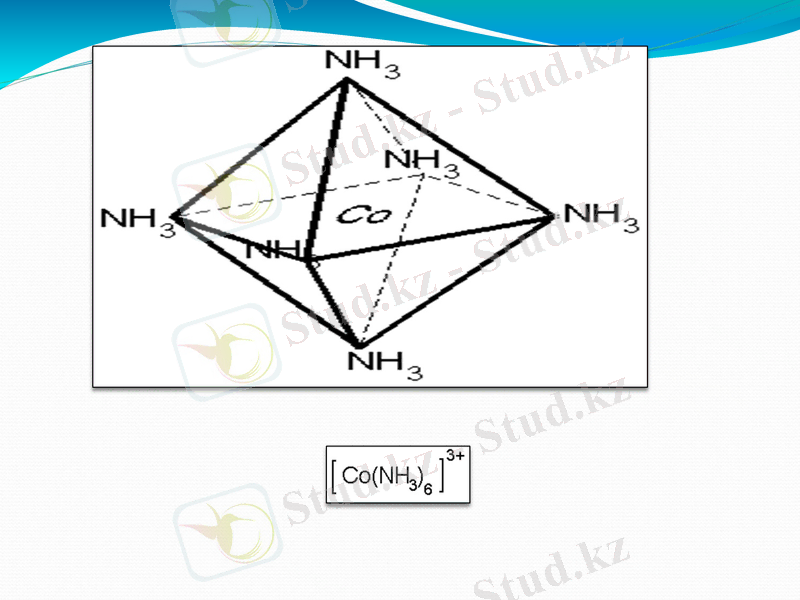
Валенттік байланыс әдісі (ВБӘ) бойынша орталық атом мен лиганд донорлы-акцепторлы жол мен байланысады. Орталық атом байланыс түзуге бос орбитальдарын, ал лиганд пайдаланылмаған электрон жұбын жұмсайды. Мысалы: : [ Co(NH3) 6 ] 3+
Co
59
27
1s²2s²2p⁶3s²3p⁶3d⁷4s²
3d⁷
4s²
4p°

Кобальт катионының валенттік қауызында төрт бос орбиталі бар.
Кобальт катионының қоздыру арқылы деңгейшесіндегі жалқы электрондарды өзара жұптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады.
Қозған күйіндегі кобальт катионының алты бос орбиталдары бар.
Аталған бос орбитальдар байланыс түзуге қатыспастан бұрын гибридті орбитальдарға айналады. Кобальт катионының аталған орбиталі молекуласының құрамындағы азот атомының екі электронды орбиталімен жұптасқанда комплексті катион түзіледі.
Кобальт катионының гибридті орбитальдары октаэдр төбесіне бағытталған. Түзілген комплекстің құрылысы октаэдр болады.

Kомплексті қосылыстар туралы ілімнің негізін жасаған швейцария
ғалымы Альфред Вернер (1893ж)
Вернер жұмысы координациялық теория деп аталады.
Координациялық теорияның негізгі қағидалары:
КҚ орталық орын алып тұрған ион немесе атом комплекс түзуші деп аталады.
Комплекс түзушінің айналасына соның әсері жететіндей жақындықта координацияланған иондарды немесе молекулаларды лигандалар (аддентер) деп атайды.
Комплекс түзуші мен лигандалар бірігіп, комплексті қосылыстың ішкі сферасын құрайды.
Ішкі сфераны квадрат жақшаға алады: [ PtCl6 ] 2-
Ішкі сфераға орналаспай қалған иондар комплекс түзушіден алысырақ орналасады, олар комплексті қосылыстың сыртқы сферасын құрайды.
Комплекс түзушінің айналасына координацияланған лигандтардың жалпы саны сол комплекс түзушінің координациялық саны деп аталады.
Жиі кездесетін комплексті қосылыстарда координациялық сан алтыға немесе төртке тең, сирек екіге, не үшке тең болады.

Комплекс түзуші ион немесе атом бұл ішкі сферасының орталық атомы(ионы) . Көбінесе р-, d-, f- элементтер жатады (бос орбитальдары бар элементтер - Cu, Au, Ag, Hg, Zn, Fe, Co, Cr т. б. )
Лигандалар -бұл молекулалар немесе иондар КТ айналасында орналасқан. Көбінесе мыналар жатады
Hal-галоген NO3-нитрат NO2 -нитрит SO4 -сульфат SO3 -сульфит CO3 -карбонат CN-циан
H2O-аква NH3-аммин CO-карбонил NO-нитроза OH-гидроксо
O-окси SCN-родано
Бұл қосылыстарда пайдаланбаған электрон жұбтары бар
Комплексті ион немесе КҚ ішкі сферасы - бұл КТ және Л тұрады.
Олар донорлы-акцепторлы байланысқан күрделі ион:
[ Аg(CN) 2] -
Комплекс ионның заряд саны сыртқы иондар зарядының қосындысына тең, бірақ кері мәнді болады.

Комплексті қосылыстың құрамы белгілі болса, комплекс түзушінің зарядын табу қиын емес. Ол үшін комплексті қосылыстың формуласына кіретін басқа иондардың барлығының зарядтарының алгебралық қосындысын шығарып оған теріс мән қояды.
Х = +1
Координациялық көлем немесе денттатылы - лиганданың КТ маңында орналасқан жерінің көлемі.
Лигандтар дентаттылығы бойынша классификацияланады:
бір дентаттылығы (1орын) - H2O, NH3, CO, NO, OH, CN, SCN, Hal
бидентаттылығы (2орын) - CO3, SO4, O, C2O4, H2N-CH2-CH2-NH2
көп дендантты -үш, төрт, бес, алты.
Комплексондар - органикалық лигандтар, өзінің құрамында алкилкарбокситобы амино тобымен байланысқан
Мысалы: (NH2СН2СООН) - α- амин қышқылы

КҚ ЖІКТЕЛУІ
I. Комплекстер ішкі сферасының зарядына қарай катионды, анионды және бейтарап болып үш топқа бөлінеді.
Катионды комплекстер орталық ионның айналасына бейтарап молекулалар (NO, NH3, H2O) координацияланғанда түзіледі.
[Al(H ₂O) ₆] Cl₃ [Al(H ₂O) ₆] ³⁺ +3Clˉ
Комплексті иондар оң зарядталған.
Анионды комплекстерде комплекс түзушінің ролін оң зарядталған ион, ал лигандтар ролін аниондар атқарады.
К[ Аg(CN) 2] [ Аg(CN) 2] - + К+
Бейтарап комплекстер атомының айналасында молекулалар координацияланғанда немесе оң зарядталған комплекс түзушінің айналасында анион мен молекулалар қатар координацияланғанда түзіледі [ Fe ( CO) 5 ]

II. Лигандтың табиғаты бойынша КҚ бөледі:
Аммиакаттар - КҚ ішікі сферасында лиганд ретінде NH3 молекуласы бар.
Аквакомплекстер - КҚ лигандттар су молекулалары болады.
Гидроксокомплекстер - лигандалары ОН-
тобы
Ацидокомплекстері - лигандалары қышқыл қалдығы.
Аралас комплекстер - лигандалары аралас.

III. Ішкі сферасының құрылысы бойынша
Комплекс түзуші иондар санына қарай бір ядролы және көп ядролы комплекстер
Жай және циклі бар комплекс, сақиналары бар комплекс. Егер бір лиганда бір координациялы орын алса, оны жәй комплекстер дейді.
Циклді немесе хелатты комплексті лигандтар полидентантты(хелаттарға комплексондар жатады СН2-NH2 H2N -CH2
Cu
СН2-NH2 H2N-CH2

IV. Геометриялық пішініне қарай
Координациялық саны 2 комплекстерде орталық атом мен екі лиганда бір түзудің бойында орналасады. Құрылысы түзу сызықты болады
Координациялық саны 3 сирек комплекс кездеседі.
Бұл комплекс тең қабырғалы үшбұрыш сияқты

Координациялық саны 4 болғанда комплексті ионның құрылысы тэтраэдр немесе квадратты болып келеді.
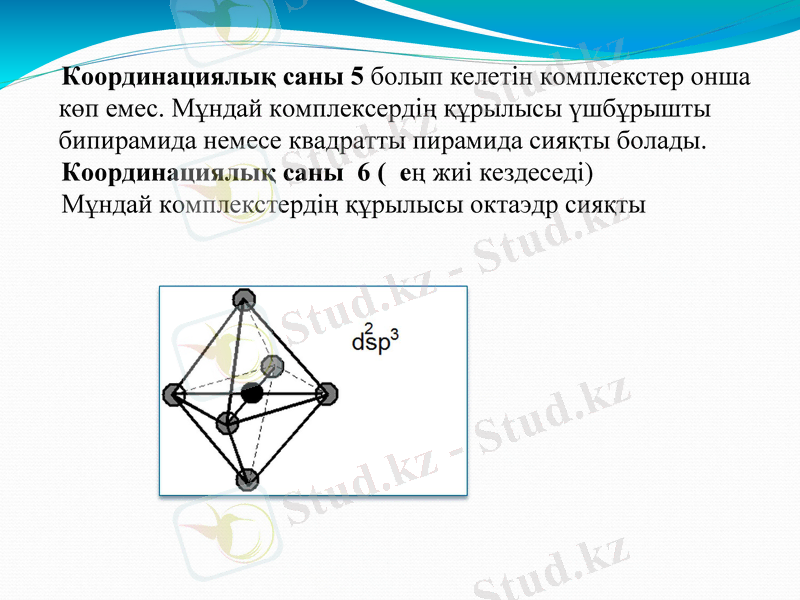
Координациялық саны 5 болып келетін комплекстер онша көп емес. Мұндай комплексердің құрылысы үшбұрышты бипирамида немесе квадратты пирамида сияқты болады.
Координациялық саны 6 ( ең жиі кездеседі)
Мұндай комплекстердің құрылысы октаэдр сияқты

КҚ номенклатурасы
1962 жылы химиктердің Халықаралық Одағы (ІUPAC) ұсынған номенклатурасы қолданылады.
Теріс зарядты лигандтардың атауына «О» деген жалғау жалғанады СI- хлоро-, СN- циано-.
Электробейтарап лигандтар былай аталады:
H2O-аква NH3-аммин CO-карбонил NO-нитрозил
OH-гидроксо O-окси т. б.
Комплекс құрамындағы лигандтардың саны грек сан есімдерімен белгіленеді:
ди (екі), три (үш), тетра(төрт), пента (бес), гекса (алты) т. б.

Катионды комплексті атағанда ішкі сферадан басталады:
Орталық атом немесе заряды көрсетіліп КТ ионы.
Саны көрсетіліп теріс зарядталған лигандттар
Саны көрсетіліп бейтарап лигандттар
Сыртқы анионды атайды

Анионды комплекстің аталуы:
Сыртқы сферадағы ионды айтады
Саны көрсетіліп теріс зарядталған лигандтар
Саны көрсетіліп бейтарап лигандтар
Комплекс түзуші атомына - ат деген жалғау жалғанады ( латынша )
Бейтарап комплексті атау үшін:
Саны көрсетіліп теріс зарядталған лигандтар
Саны көрсетіліп бейтарап лигандтар
Комплекс түзуші атомы аталады

КҚ изомериясы
Изомерлер- құрамдары бірдей, бірақ құрылысы мен қасиеттері әртүрлі заттар. Изомерия құбылысы комплексті қосылыстарда өте кең таралған
Гидраттық немесе сольватты изомерия су молекуласының комплекс құрамында әртүрлі орналасуынан болады.
[Сr(Н2О) 6] Сl3, [Сr(Н2O) 5Сl] Сl 2*Н2O, [Сr(Н2O) 4Сl2] Сl *2Н2O
күлгін түсті күлгін-жасыл жасыл
Иондық изомерия аниондардың ішкі сфера мен сыртқы сфераға әртүрлі таралуынан болады.
[Pt(NH3) 3Br] NO2 және [Pt(NH3) 3(NO2) ] Вr

Координациялық изомерия - екі түрлі лигандтардың екі комплекс түзушінің айналасына әртүрлі жолмен координациялануынан болады.
[Co(NH3) 6] [Cr(C2O4) 3] и [Cr(NH3) 6] [Co(C2O4) 3 ]

Геометриялық изомерия - комплекс құрамында кем дегенде екі түрлі лиганд болғанда байқалады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz