Қышқылдар мен негіздердің теориялары және электролиттік диссоциация: Аррениус, Бренстед-Лоури және Льюис



Тақырыбы: Қышқылдар мен негіздер теориялары. Бренстед-Лоуридің протолитикалық теориясы, протолитикалық реакциялардың теңдеуін құрастыру.
Орындаған: 1 курс 1 топ студенті Салиева Диана
Қабылдаған: Химия пәнінің оқытушысы Жантеева Гүлрайхан Ендібайқызы
Қазақстан білім және білім ғылым министрлігі Т. К. Жургенов Қазақ ұлттық өнер академиясы колледжі

Жоспар:
Кіріспе
Негізгі бөлім: 1. Электролиттердің жіктелуі 2. Диссоциация туралы жалпы түсінік 3. Қышқылдар мен негіздердің Аррениус және Льюис бойынша ілімі. 4. Қышқылдар мен негіздердің протолиттік ілімі.
Қорытынды

Кіріспе:
Қышқылдар мен негіздердің теориясын С. Аррениус өткен ғасырдың соңында ұсынған болатын. Ол электролиттік диссоциация, бірақ бұл электролиттік диссоциация ілімі органикалық қосылыстардың аминдердің, амидтердің тағы басқа қышқылдық-негіздік қасиеттерін түсіндіре алмады. Бұл теорияны 1923 жылы Бренстед және ағылшын химигі Лоури қышқылдар мен негіздердің протолиттік ілімін ұсынды. Протолиттік ілім бойынша, қышқылдар дегеніміз иондану нәтижесінде протондар түзетін, ал негіздер протонды қосып алатын қосылыстар. Протолиттік теория ілеспелі қышқылдар мен негіздер деген ұғымды енгізді. Қышқылдық-негідік әрекеттесудің барлық реакцияларында, қышқылдан негізге протондар қайтымды тасымалданады тұрады, олар жаңа бөлшектер жұбын түзеді, олардың біреуі қайтадан протон беруге екіншісі оны қабылдап алуға бейім. Протондардың ауысуымен сипатталатын реакцияларды протолиттік реакциялар деп, ал түзілетін тепе-теңдікті протолиттік тепе-теңдік деп атайды. Протолиттік ілімде еріткіштің протолизі маңызды орын алады. Сулы емес еріткіштер де су сияқты сольваттанған протонға және анионға протолизденеді.

Электролиттердің жіктелуі
Көптеген химиялық реакциялар ерітінділер арасында жүреді. Ерітінділерді электролиттер деп те атайды. Электролиттер деп еріткіш молекулаларының әсерінен иондарға ыдырап, ерітінділері не балқымалары электр тогын өткізетін заттарды айтады.

Электролиттердің ерекшеліктері:
1. Ерітінділері электр тогын жаксы өткізеді. 2. Электролиттердің концентрациясы бірдей ерітінділер буының қысымы төмен, қайнау температурасы жоғары, қату температурасы төмен. 3. Электролит ерітінділерінің осмос қысымы жоғары.
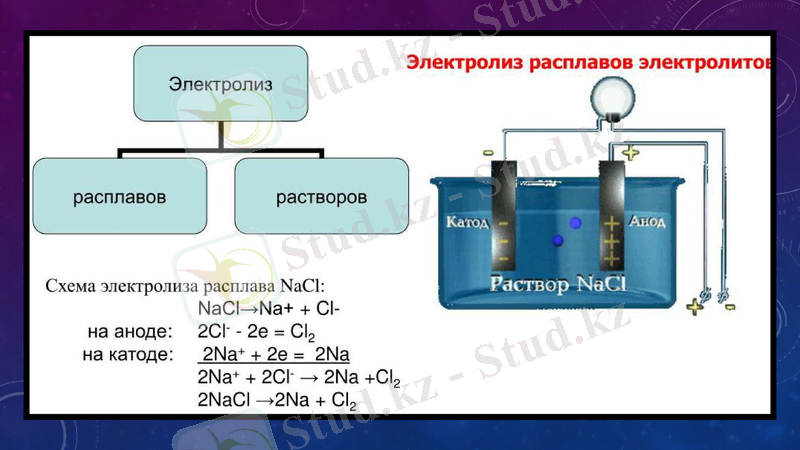

Диссоциация туралы жалпы түсінік
Электр тоғын өткізетін заттар электролиттер, ал өткізбейтін заттар бейэлектролиттер болады. Электролит ерітінділеріндегі кездесетін ауытқуларды швед химигі С. Аррениус ұсынған электорлиттік диссосация теориясы түсіндірді. Бұл теорияның негізі мынада: 1. Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы. 2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар) . 3. Диссоциация - қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді. (ассоциация) . Диссоциация теңдеуін құрғанда тепе-теңдік белгісін қояды (=) . Мысалы КА затының диссоциациясын былай жазуға болады: КА =К++А-

Электролиттік диссоциация теориясы
Электролиттердің еру немесе балқу процессі электр тогын өткізе алатын зарядталған бөлшектер түзе жүретін процесс. Электролиттік диссоциация ерітіндідегі электролиттер полярлы еріткіштердің әсерінен иондарға ыдырауы. Иондар атомдардан ерекшеленеді. Ерітіндіде иондар ретсіз қозғалады. Тұрақты электр тогы әсерінен электролит ерітіндісіндегі иондар бағытталып қозғалады: катиондар катодқа, аниондар анодқа тартылады.
С. А. Аррениус (1859-1927)

Электролиттік диссоциация дәрежесі (α) иондарға ыдыраған молекулалардың электролит молекулаларының жалпы санының қатынасына тең шама. Мұнда n - иондарға ыдыраған молекулалардың саны. N0 -жалпы молекулалардың саны.
Күшті электролиттерге α › 0, 3 (немесе 30%) жоғары, ал әлсіз электролиттер үшін α ≤ 0, 03(немесе 3%), орташа электролиттер олардың диссоциациялану дəрежелері 3% пен 30%аралығында болады. Электролиттік диссоциациялану дәрежесі концентрацияға тәуелді, концентрация төмендеген сайын α жоғарлайды.

Оствальдың сұЙылту заңы
Электролиттік диссоциация дәрежесі мен диссоциация тұрақтысының өзара байланысы сандық түрде Оствальдтың сұйылту заңы деп аталатын теңдеуімен беріледі: K = α2 C/ 1- α Әлсіз электролиттер үшін α шамасын ескермеуге болады, онда 1-α =1 деп алса, теңдеу мына түрде жазылады: КД ═ α2 ∙ С
Вильгельм Оствальд

Электролиттік диссоциация константасы
Әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді.

Әлсіз электролиттердің диссоциациясы қайтымды процесс болғандықтан әрекеттесуші массалар заңына бағынады: К=[H+] [CH3COO-] /[CH3COOH] ; К - диссоциациялану константасы. Көп қышқылды негіздер мен көп негізді қышқылдар біртіндеп (сатылап) иондарға ыдырайды және сатының әрқайсысына тиісті мәні бар диссоциациялану константасы сәйкес келеді. H2CO3 ⇔ H+ + HCO-3 К1 =4, 5⋅10-7 HCO-3 ⇔ H+ + CO32- К2=4, 7⋅10-11


Қышқылдар мен негіздердің Аррениус және Льюис бойынша ілімі.
Льюс анықтамасы бойынша қышқыл болатын қосылыстар өзіне электрон жұбын қосып алуға қабілетті, ал негіздер - электрон жұбын беруші қосылыстар. Мұндай әрекеттесудің нәтижесінде коваленттік байланыс түзіледі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz