Дайын дәрі-дәрмектерді өнеркәсіптік өндірудегі нормативтік-техникалық құжаттама, валидация және GMP талаптары



П р е з е н т а ц и я
Тақырыбы:Дайын дәрі-дәрмектер-дің өнеркәсіптік өндірі-сіндегі нормативтік-техникалық құжаттама. Өндірістік нысандарға, жабдықтарға, қызмет-керлерге қойылатын GMP талаптары.
Орындаған: Абылаева А.
Тобы: ФӨТҚБ-06-18
Қабылдаған: Бахтиярова Б
Шымкент, 2021ж
«Фармацевттік өндірістің технологиясы» кафедрасы
ОҢТҮСТІК
ҚАЗАҚСТАН
МЕДИЦИНА
АКАДЕМИЯСЫ
ЮЖНО-
КАЗАХСТАНСКАЯ
МЕДИЦИНСКАЯ
АКАДЕМИЯ

Жоспар
Кіріспе
Негізгі бөлім
Дайын дәрі-дәрмектерді өнеркәсіптік өндірудегі нормативтіктехникалық құжаттама.
Валидация ұғымы.
Өндірістік нысандарға, жабдықтарға, қызметкерлерге қойылатын GMP талаптары.
Қорытынды
Пайданалынған әдебиеттер

Кіріспе
Дәрілердің өнеркәсіптік өндірісі белгіленген тәртіп бойынша бекітілген, сәйкес нормативті техникалық құжатпен НТҚ регламенттеледі.
НТҚ дәрілік препараттардың сапасы және әсерлігін жоғарылатуды қамтамасыз етуі керек, ғылым және техника жетістіктері негізінде үнемі жетілдірілуі керек және денсаулық сақтау, мемлекеттік қорғау, экспорт талаптарына сай дер кезінде ескірген көрсеткіштерді ауыстыру мақсатында қайта қаралады.

Дайын дәрі-дәрмектерді өнеркәсіптік өндірудегі нормативтіктехникалық құжаттама.
Нормативтік құжат - бұл әртүрлі қызметтер немесе олардың нәтижелеріне қатысты ережелер, жалпы принциптер немесе сипатмалар бекітетін құжат.
Дәрілік зат, дәрілік өсімдік шикізаттары және медициналық техника бұйымдарына НТҚ келесі категорияларға бөлінеді:
1. Технологиялық және техникалық регламенттер.
2. Мемлекеттік фармакопея.
3. Фармакопеялық мақалар.
4. Уақытша фармакопеялық мақалар.
5. Мемлекеттік стандарттар.
6. Салалық стандарттар.
7. Техникалық шарттар.
8. Жетекші нормативті құжат - инструкциялық, әдістемелік нұсқаулар
9. Өндірістік және технологиялық инструкциялар.

Валидация ұғымы
Валидация-өнімдердің сапасын көрсеткіш күтілетін нәтижелер бойынша өндіріс жағдайына қатысты GMP ережелерінің тармағы. Фармацевтикалық препараттарды өндіруде процестің валидациясының мақсаты тек қана өнім сапасын мақсатында емес, сонымен қатар критикалық процесс кезінде сапа дәрежесін және оны жоюдың жолдарын табу болып табылады. Сондықтан валидация процесінің нәтижелері өндірісті қажеттілігін жетілдіруге жол көрсетеді.
Валидация сұрақтары әр қашан үлкен қызығушылық көрседі, сонымен қатар кейбір валидация әдістерінің аспектілері мен процесстері егжей-тегжей қарстырылмаған. Сондықтан, осы аймақ бойынша көптеген сұрақтарды зерттеуші (өндіруші) өздігінше шешу керек.

Бұл халықаралық сапа стандарттарына сәйкес фармацевтикалық өнімдер өндірісін үнемі қолдау және бақылауды қамтамасыз ету жүйесі болып табылады. Сонымен бірге, фармацевтикалық өнім сапасын шикізат пен материалдардан бастап дайын өнімді шығарғанға дейінгі, оның ішіне тасымалдау мен сақтауды да ескере отырып, бақылау да кіреді.
GMP негізгі мақсаты-өндірілген өнімнің сапасының жоғары екендігіне кепіл болу.
Соңғы өнімнің сапасына әсерін тигізетін әр үрдіс үшін арнайы нұсқаулар мен жүйелер, өндірістің әр кезеңінде орындалатын барлық тиісті рәсімдерді растайтын құжаттар жасалған. GMP стандарты фармацевтикалық өндірістің барлық кезеңдерінде сапасыз өнім алу тәуекелін азайтуға шақырады.
.
Тиісті өндірістік тәжірибе - GMP (Good Manufacturing Practice) .

GMP стандартына сай өндіріс орындарының құрылысы ең басты мақсат - өнімнің таза болуына бағынуы тиіс.
Мұндай өндіріс орындарында шаң-тозаң жиналатын жерлердің аз болуы қолға алынады, тазалығы бақыланып отыратын ауа жіберу қамтамасыз етіледі, жоғары қысым, белгілі температура мен ылғалдылық әрдайым бір қалыпта ұсталып отырады. Мұндай өндіріс орындары «таза» деп аталады.
Біздің елімізде «таза» өндіріс орындарында ауа қысымы айырмашылығы 4мм. сын. бағ., температура 23+20С, салыстырмалы ылғалдылығы 30-40%болуы қамтамасыз етіледі.

1
2
Тиісті өндірістік тәжірибе (GMP)
Өнімнің үнемі сапа стандартына және тіркеу досьесі немесе осы өнім спецификациясы талаптарына сәйкес бақыланып, өндірілетініне кепілдік беретін сапаны қамтамасыз етудің бір бөлігі болып табылады.
GMP негізгі талаптары
- барлық өндірістік үрдістер айқын анықталған болуы тиіс және оларды жүре пайда болған тәжірибелерді ескере отырып, жүйелі түрде қадағалау қажет;
- өндірістік үрдістің критикалық сатысы мен үрдістегі маңызы бар өзгерістер валидациялануы тиіс;
- GMP арналған барлық құралдар болуы қажет.
Қызметкерлерге қойылатын GMP талаптары
Өндіруші қарамағында қажетті біліктілігі мен практикалық тәжірибесі бар тиісті қызметкерлер болуы.
Өндірушіде әрбір қызметкер сәйкес жұмыс орнында белгілі міндеттерін орындайтын схема болуы тиіс.
Басшы қызметкерлер: өндіріс және бөлім жетекшілері, олар бір-біріне бағынбайтын уәкілетті тұлғалар.
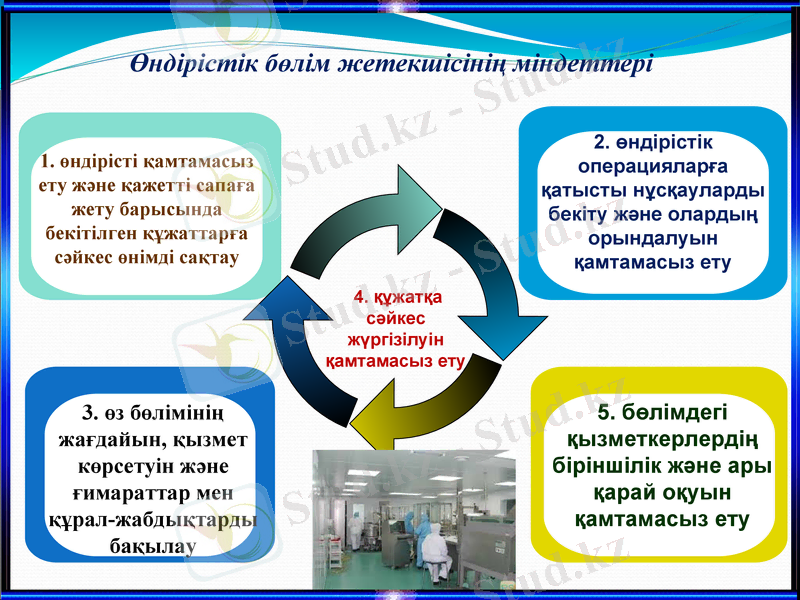
4. құжатқа сәйкес жүргізілуін қамтамасыз ету
3. өз бөлімінің жағдайын, қызмет көрсетуін және ғимараттар мен құрал-жабдықтарды бақылау
1. өндірісті қамтамасыз ету және қажетті сапаға жету барысында бекітілген құжаттарға сәйкес өнімді сақтау
5. бөлімдегі қызметкерлердің біріншілік және ары қарай оқуын қамтамасыз ету
2. өндірістік операцияларға қатысты нұсқауларды бекіту және олардың орындалуын қамтамасыз ету
Өндірістік бөлім жетекшісінің міндеттері

жұмысқа қабылданар алдында медициналық тексеруден өтуі тиіс
жұқпалы аурулармен немесе ашық жаралармен өндіріске кіруге тиым салынады
орындалатын жұмыс түріне байланысты қорғаныш киімін кию қажет
өндіріс аймағында тамақтануға, сусын ішуге жіне тағам, сусындар, табак өнімдерін сақтауға тиым салынады
ашық өнім мен оператор қолының тікелей жанасуынан абай болған жөн.
Ғимараттар мен қондырғыларға қойылатын талаптар
1. ғимараттар мен қондырғылардың орналасуы, жобалануы, лайықты жабдықталуы, пайдаланылуы жүргізілетін операциялар түрлеріне байланысты талапқа жауап беруі тиіс;
2. олардың орналасуы мен конструкциясы өте аз тәуекелга әкелуі қажет;
3. қиыстырылған контаминацияны болдырмау мақсатында тиімді тазалау және қызмет көрсету мүмкіндігін қамтамасыз ету қажет.
Қызметкерге қойылатын талаптар

Ғимараттар. Жалпы талаптар
сақтықпен пайдаланып, қызмет көрсетуін қадағалау және жөндеу мен эксплуатацияның өнім сапасына ешқандай қауіп тудырмайтынына кепілдік беріледі
жазбаша әдістемеге сәйкес жинау және дезинфекциялау талап етіледі
жарықтандыру, ылғалдылық, температура және желдету талапқа сай болуы және олардың өнім сапасына, қондырғы қызметінің дәлдігіне жағымсыз әсер көрсетпеуі талап етіледі
1
2
3

4. Ғимаратқа бөгде адамдардың кірмеуі үшін барлық шаралар қолданылуы тиіс
Ғимараттар. Жалпы талаптар

Өндірістік ғимараттар
биологиялық препараттар дайындау үшін бөлек бөлмелер болуы қажет
ғимараттарды жоспарлау өндірістік үрдіс операцияларының қисынды кезектілігі мен тазалықтың қажетті деңгейіне сәйкес жүргізіледі
ағындар өлшемге сәйкес және кері ағынды болдырмайтындай жабдықталуы қажет
бастапқы шикізатты өлшеу бөлек бөлмелерде жүргізіледі
ішкі қабырғалары (қабырғалар, еден және бөлме төбесі) тегіс және жылтыр, жарықшақсыз, жеңіл тазаланатын болуы керек
құбырлар, желдеткіш қондырғылар жобаланған және тазалауда қиындық тудырмайтындай тереңдікте орналасуы керек

Қойма ғимараттары
әртүрлі категориялы материалдар мен өнімдерді дұрыс сақтау үшін сиымды болуы керек
карантин болған жағдайда бөлек бөлмелерде азықтардың сақталуы қамтамасыз етіледі және ондай зоналар маркирленуі тиіс
бастапқы шикізат сынамасын сұрыптауға арналған бөлек зона
күшті әсер ететін заттар немесе өнімдер қауіпсіз және қорғалған зоналарда сақтау талап етіледі
1
3
2
4
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz