Күшті және әлсіз қышқылдар мен негіздердің титрлеу қисықтарын есептеу және тұрғызу



Тақырыбы:Титрлеу қисықтарын (күшті, әлсіз қышқылдар мен негіздердің) есептеу және тұрғызу.
Орындаған:Жарылқасынова Айкен
Тобы:ФӨТҚА 201-19
Қабылдаған:Дилдабекова Л.
Қазақстан Республикасы
Денсаулық Сақтау
Министрлігі
Оңтүстік Қазақстан
Медицина Академиясы АҚ
Презентация
Химиялық пәндер кафедрасы
Шымкент-2021 жыл

Жоспары:
І Кіріспе
ІІ Негізгі бөлім
1. Титриметриялық талдау.
2. Титрлеу түрлері
3. Индикаторлык қателер және оларды есептеу жолдары.
ІІІ Қорытынды
ІV Пайдаланылған әдебиеттер

Кіріспе
Титриметриялық талдау (титрлеу) - аналитикалық химияда жиі қолданылатын, белгілі концентрацияның реагент ерітіндісінің көлемін өлшеуге негізделген, аналитикпен реакцияға жұмсалатын сандық / массалық талдау әдісі. Титрлеу - бұл бір ерітінді екінші ерітіндіге қосылатын процесс, осылайша ол қосылған көлемді дәл өлшеуге болатын жағдайларда әрекет етеді. Анықталған аналитиктің белгісіз концентрациясын анықтау үшін сандық аналитикалық химияда қолданылады. Титрлеу көбінесе қышқыл негізіндегі реакциялармен байланысты, бірақ олар реакцияның басқа түрлерін де қамтуы мүмкін. Титрлеу сонымен қатар титриметрия немесе көлемді талдау деп аталады. Белгісіз концентрацияның химиясы аналит немесе титр деп аталады. Белгілі концентрация реагентінің стандартты ерітіндісі титрант немесе титрор деп аталады. Реакцияланған титрдың көлемі (әдетте түс өзгеруі үшін) титрлеу көлемі деп аталады.

Титрлеу түрлері
Титриметрияда титрлеу жолына карай титрлеу тәсілдерін үшке бөледі:
1. Тура титрлеу әдісінде анықталатын ионды тікелей жұмыс ерітіндісімен (титрантпен) титрлейді.
2. Кері титрлеу әдісі (не қалдык бойынша титрлеу әдісі) мұнда зерттелетін ерітіндіге концентрациясы белгілі ерітіндінін дәл өлшеп алынган ерітіндісінің артық мөлшерін құяды (І титрант), Реакцияға түспей қалған І титрантты концентрациясы белгілі ІІ титрантпен титрлейді.
3. Жанама немесе орынбасу титрлеу әдісінде аныкталатын заттың ерітіндісіне қосымша бір затты қосады, жана зат түзіледі, түзілген затты титрантпен титрлейді.
Титриметрлік әдістерді қолданылатын химиялык реакцияларға байланысты 4 топка жіктейді:
1. Қышқылдық-негіздік титрлеу (бейтараптану негізделген) ; реакциясына
2. Тотығу-тотықсыздану (редоксиметрия) әдісі (редокс реакцияларға негізделген) ;
3. Тұндыру титрлеу (аз еритін косылыстарды тұндыру реакциясына негізделген) ;
4. Комплексонометрлік титрлеу (анықталатын компонент пен титрант арасында берік комплексті қосылыстың түзілу реакциясына негізделген) .



Титрлеу қисықтары
Тотығу-тотықсыздану реакцияларының титрлеу қисықтарын, әдетте тотығу-тотықсыздану потенциалы-қосылған жұмысшы ерітіндінің көлемі координаталарында тұрғызылады. Емв-Vт
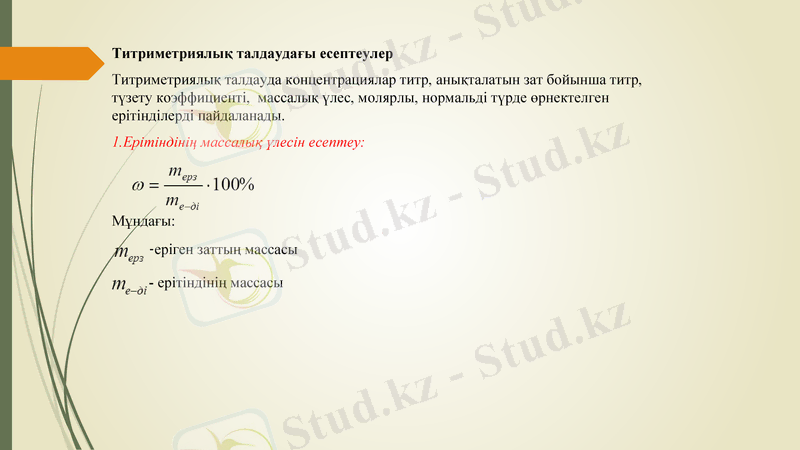
Титриметриялық талдаудағы есептеулер
Титриметриялық талдауда концентрациялар титр, анықталатын зат бойынша титр, түзету коэффициенті, массалық үлес, молярлы, нормальді түрде өрнектелген ерітінділерді пайдаланады.
1. Ерітіндінің массалық үлесін есептеу:
Мұндағы:
-еріген заттың массасы
- ерітіндінің массасы

2. Ерітіндінің молярлы концентрациясын есептеу:
немесе
Мұндағы:
V- ерітіндінің көлемі, см3;
-ерітіндінің тығыздығы, г/см3;
-ерітіндінің массалық үлесі, %;
М - заттың молярлы массасы, г/моль.
- моль саны, моль;

3. Ерітіндінің нормальді концентрациясын есептеу:
немесе
Мұндағы:
- моль саны, моль;
-ерітіндінің массалық үлесі, %;
- эквиваленттік факторы;
Э -эквивалентінің молярлы массасы, г/моль.
V- ерітіндінің көлемі, см3;

4. Көлемі белгілі ерітінді дайындау үшін өлшендінің массасын есептеу:
Мұндағы:
N -ерітіндінің нормальді концентрациясы;
W - ерітіндінің көлемі, см3;
Э -эквивалентінің молярлы массасы, г/моль.
- химиялық таза заттың өлшенді массасы, г;

5. Ерітіндінің титрін есептеу:
немесе
Мұндағы:
Т - ертіндінің титрі, г/см3;
W - ерітіндінің көлемі, см3;
N -ерітіндінің нормальді концентрациясы;
Э -эквивалентінің молярлы массасы, г/моль.
а- өлшендінің массасы, г;

Титрлеудің соңғы нүктесін әртүрлі тәсілдермен анықтауға болады. Іс жүзінде жиі қолданылатын тәсілдердің бірі - индикаторлық тәсіл. Яғни, титрлеудің соңғы нүктесі индикатор түсінің өзгеруімен анықталады. Индикатор дегеніміз - эквиваленттік нүктеде немесе оған жақын нүктеде өзінің түсін өзгертетін әлсіз органикалық қышқылдар немесе негіздер. Индикаторды дұрыс таңдаған жағдайда, эквиваленттік нүкте титрлеудің соңғы нүктесіне сәйкес келеді. Қышқылдық-негіздік титрлеу әдісінде қышқылдық- негіздік немесе рН индикаторлар пайдаланылады, бұл индикаторлар ерітіндінің рН мәніне тәуелді түсін өзгертеді, мысалы: фенолфталеин, метил қызыл сарысы (метилоранж), лакмус, метилқызыл т. б. Индикаторларға қойылатын шарттар: 1. Индикаторлар эквиваленттік нүктеде немесе оған жақын нүктеде өзінің түсін өзгертуі тиіс, осы жағдайда титрлеу қатесі төмен болады. 2. Индикатор титрантпен жоғары жылдамдықта әрекеттесуі тиіс.
Индикаторлар теориясы. Индикаторлардың сандық сипаттамалары Индикаторларды сипаттайтын бірнеше теория бар: 1. Иондық теория немесе Оствальд теориясы. Бұл теория бойынша қышқылдық-негіздік титрлеуде пайдаланылатын индикаторлар ерітіндінің рН- ына байланысты өзінің түсін өзгертетін әлсіз органикалық қышқылдар немесе негіздер. Бұл тәсілде индикаторлардың молекула түрі мен ион түрінің түстерінде айырмашылық болады. Мысалы, индикатор лакмусты алсақ, қышқыл ортада түсі - қызыл (молекула түрі), сілтілік ортада түсі - көк (ион түрі) .

Индикаторды таңдап алу үшін титрлеудің қисықтар әдісінен басқа титрлеудің индикаторлық қателіктер әдісін пайдалануға болады. Пайдаланылатын индикатордың титрлеу көрсеткішінің эквивалент нүктесіндегі, рН шамасына дәл келмейтіндігі, титрлеудің индикаторлық қателігі деп аталады.
Индикаторлык қателер және оларды есептеу жолдары.
Индикаторды дұрыс таңдау үшін титрлеу қисығын тұрғызады немесе титрлеудің индикаторлық қателігін есептейді. Индикаторлар өзінің түсін өзгертетін pH мәні эквиваленттік нүктеге сәйкес келе бермейді, осыған байланысты зерттелетін ерітінді кейде кішкене титрленбей қалады, кейде кішкене артық титрленеді, яғни біршама қателер кетеді. Индикаторлық қателерге әртүрлі факторлар әсер етеді (температура, концентрация, бөгде электролиттер, еріткіштің табиғаты, индикатордың концентрациясы, титрлік peтi) .
Индикаторлық кателердін түрлері
1. Сутектік қате. Титрлеу аяқталғанда ерітіндіде артық сутекпиондарының болуымен анықталады.
2. Гидроксидтік қате. Титрлеу аяқталғанда ерітіндіде артық гидроксил иондарының болуымен сипатталады.
3. Қышқылдық қате. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз қышқыл молекулаларының болуымен анықталады.
4. Негіздік қате. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз негіз молекулаларының болуымен анықталады.

Сутектік қателік және оны есептеу Н+
Индикатордың титрлеу көрсеткіші- рТ;
Күшті қышқылдың концентрациясы - СЭ(НСІ),
Күшті қышқылдың көлемі - V1,
Титрлеу аяқталғандағы ерітіндінің көлемі - V2.
Бастапқы кездегі сутек ионының мөлшері
Титрлеуді рН = рТ болғанда аяқтайтын болса, онда титрленбей қалған сутек иондарының концентрациясы келесі теңдеумен анықталады СН+ =10-Рт
онда V2 көлемдегі сутек ионының мөлшері
Қатенің пайыздық шамасы (%) :

Гидроксильдік қате және оны есептеу (ОН-қате) .
Индикатордың титрлеу көрсеткіші - рТ,
Күшті сілтінің концентрациясы - Сэ(NaOH), Күшті сілтінің көлемі - V1,
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz