Бензол: электрондық құрылысы, σ- және π-байланыстар, ароматтылық, резонанс және электрофильді орынбасу (SE2) механизмі



Органикалық химияның күрделі қосылыстары 2-тапсырма
Орындаған: Налыхан Назерке

Тапсырма:
Бензол.
Ароматтылық.
Бензолдың электрондық құрылысы, σ- және π-байланыстар схемасы.
Бензол құрылысын квантхимиялық тұрғыдан түсіндіру.
Бензолдың структуралық изомерлері, резонансты (шектелген) структуралар, мезоформула.
Хюккельдің ароматтық ережесі.
Электрофильді орынбасу реакциясы. (SE2) механизмінің жалпы түрі, σ- және π - комплекстердің түзілуі, ароматты көмірсутектердің тотықсыздануы.

Бензол
Арендер- молекулаларының құрамында бензол сақинасы (бензол ядросы) бар жалпы формуласы СnH2n-6 болатын карбоциклді көмірсутектер.
Бензол, С6Н6 - ароматты көмірсутек; түссіз, қауіпті, өзіне тән иісі бар, буланғыш сұйық зат, балқу t 5, 5°С, қайнау t 80, 1°С, буы ауамен араласып, қопарылғыш қоспа түзеді. Ол органикалық еріткіштерде (эфирлерде, спиртте, ацетонда, сірке қышқылында) ериді. Бензол полярлы емес қосылыстар үшін жақсы еріткіш болып табылады, майларды, резеңке, каучук, күкірт, йодты ерітуде қолданылады. Бензол ежелден бері келе жатқан органикалық қосылыс, бензолды алғаш рет 1825 жылы Майкл Фарадей ашқан. Бензолдың құрылымдық формуласын ең алғаш неміс ғалымы А. Кекуле ұсынды(1865ж) .

Ароматтылық
Көптеген органикалық қосылыстардың ерекше ұқсас физикалық және химиялық қасиеттерін біріктіретін түсінікті «ароматтылық» деп атайды.
Ароматты қосылыстардың негізгі ерекшеліктерінің бірі- ол молекуладағы π-электрондар тығыздығының бірқалыпты таралуы болып келеді. Молекуладағы π-электрондардың бірыңғай тұйық жүйені құруы ароматтылықтың негізгі белгісі болады. Ароматты қосылыстар Э. Хюккель ережесіне бағынады: Егер қосарланған π-электрондар жүйесі бар, құрылымы жазық қосылыстарда, π-электрондар саны 4n+2 (n=0, 1, 2, 3 және т. б), яғни 2, 6, 10 және т. б, электрондар болса, онда олар ароматты болып келеді.
Ароматты қосылыстар көбінесе қосылу реакцияларына түседі. Ароматты қосылыстар ерекше тұрақты. Олардың молекулаларының құрылымы жазық (копланарлы) болады.
Аромтатты қосылыстардағы көміртек атомдарының арасындағы байланыстар (мысалы: бензолда) ароматты байланыс деп аталады.
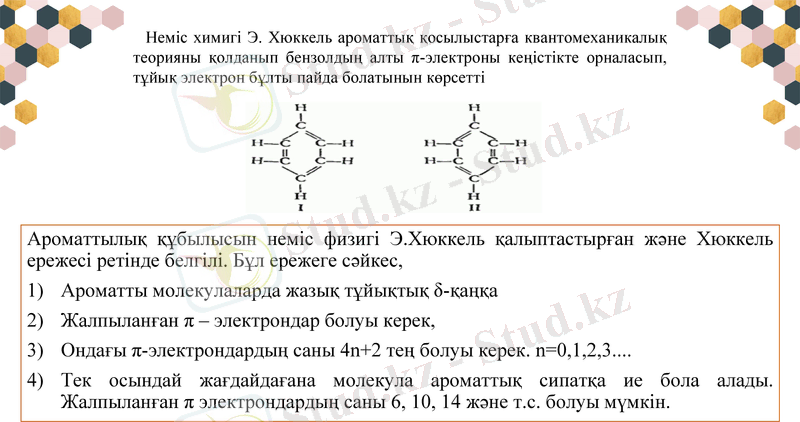
Ароматтылық құбылысын неміс физигі Э. Хюккель қалыптастырған және Хюккель ережесі ретінде белгілі. Бұл ережеге сәйкес,
Ароматты молекулаларда жазық тұйықтық δ-қаңқа
Жалпыланған π - электрондар болуы керек,
Ондағы π-электрондардың саны 4n+2 тең болуы керек. n=0, 1, 2, 3 . . .
Тек осындай жағдайдағана молекула ароматтық сипатқа ие бола алады. Жалпыланған π электрондардың саны 6, 10, 14 және т. с. болуы мүмкін.
Неміс химигі Э. Хюккель ароматтық қосылыстарға квантомеханикалық теорияны қолданып бензолдың алты π-электроны кеңістікте орналасып, тұйық электрон бұлты пайда болатынын көрсетті
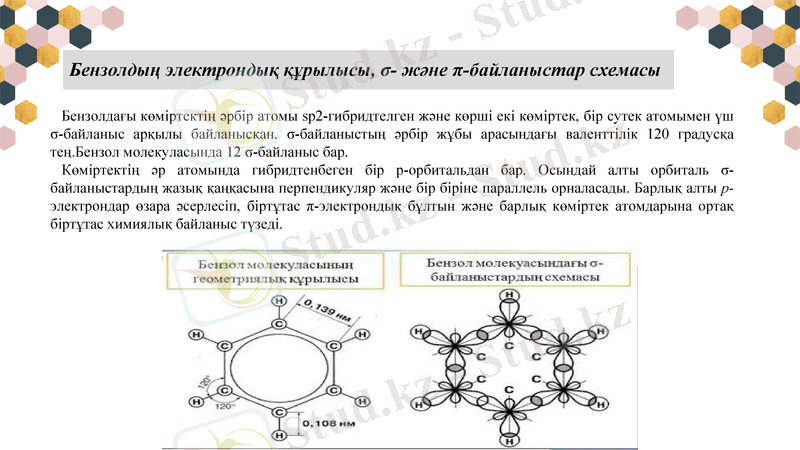
Бензолдың электрондық құрылысы, σ- және π-байланыстар схемасы
Бензолдағы көміртектің әрбір атомы sp2-гибридтелген және көрші екі көміртек, бір сутек атомымен үш σ-байланыс арқылы байланысқан. σ-байланыстың әрбір жұбы арасындағы валенттілік 120 градусқа тең. Бензол молекуласында 12 σ-байланыс бар.
Көміртектің әр атомында гибридтенбеген бір p-орбитальдан бар. Осындай алты орбиталь σ-байланыстардың жазық қаңқасына перпендикуляр және бір біріне параллель орналасады. Барлық алты р-электрондар өзара әсерлесіп, біртұтас π-электрондық бұлтын және барлық көміртек атомдарына ортақ біртұтас химиялық байланыс түзеді.
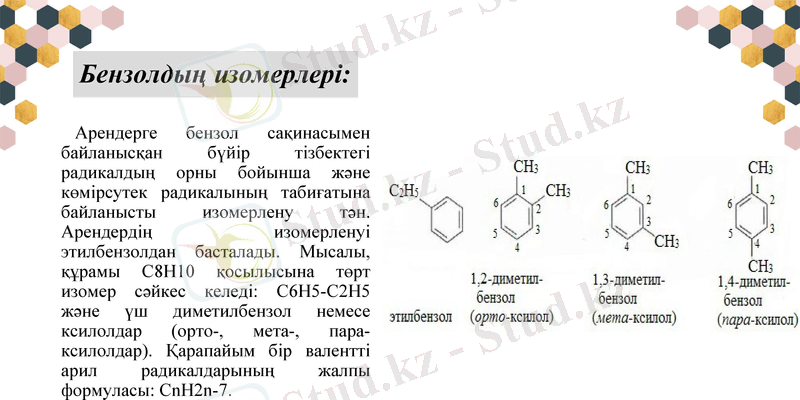
Бензолдың изомерлері:
Арендерге бензол сақинасымен байланысқан бүйір тізбектегі радикалдың орны бойынша және көмірсутек радикалының табиғатына байланысты изомерлену тән. Арендердің изомерленуі этилбензолдан басталады. Мысалы, құрамы С8Н10 қосылысына төрт изомер сәйкес келеді: С6Н5-С2Н5 және үш диметилбензол немесе ксилолдар (орто-, мета-, пара-ксилолдар) . Қарапайым бір валентті арил радикалдарының жалпы формуласы: CnH2n-7.
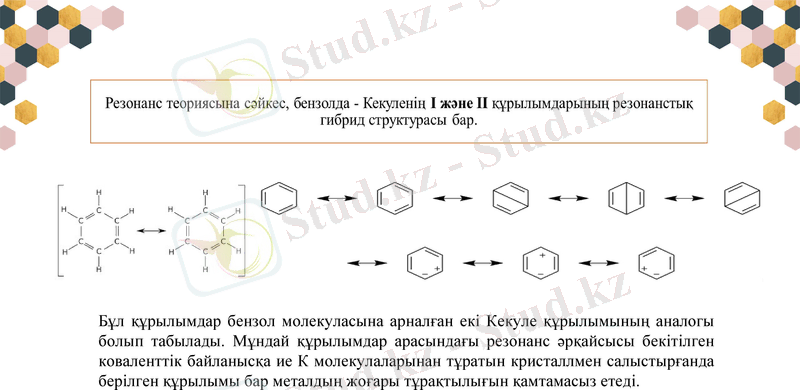
Бұл құрылымдар бензол молекуласына арналған екі Кекуле құрылымының аналогы болып табылады. Мұндай құрылымдар арасындағы резонанс әрқайсысы бекітілген коваленттік байланысқа ие К молекулаларынан тұратын кристаллмен салыстырғанда берілген құрылымы бар металдың жоғары тұрақтылығын қамтамасыз етеді.
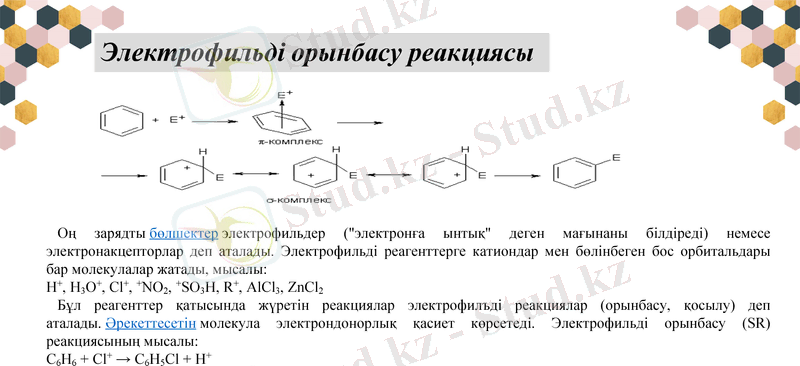
Электрофильді орынбасу реакциясы
Оң зарядты бөлшектер электрофильдер ("электронға ынтық" деген мағынаны білдіреді) немесе электронакцепторлар деп аталады. Электрофильді реагенттерге катиондар мен бөлінбеген бос орбитальдары бар молекулалар жатады, мысалы:
Н+, Н3O+, Cl+, +NO2, +SO3H, R+, АlCl3, ZnCl2
Бұл реагенттер қатысында жүретін реакциялар электрофилъді реакциялар (орынбасу, қосылу) деп аталады. Әрекеттесетін молекула электрондонорлық қасиет көрсетеді. Электрофильді орынбасу (SR) реакциясының мысалы:
С6Н6 + Cl+ → С6Н5Cl + Н+

SE2 механизмінің жалпы түрі
SE2 механизмінің жалпы түрі
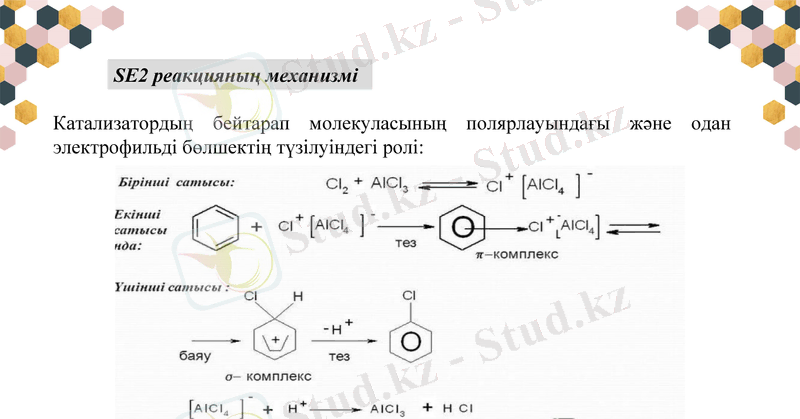
Катализатордың бейтарап молекуласының полярлауындағы және одан электрофильді бөлшектің түзілуіндегі ролі:
SE2 реакцияның механизмі

Ароматты көмірсутектердің тотықсыздануы
Ароматты қосылыстар тотығу реакцияларға тұрақты. Қалыпты жағдайда бензолға әсер етпейді, төменгі тотықтырғыштар: HNO3, K2Cr2O7, H2SO4, KMnO4. Ал тотықсыздану реакциясында бензолдан циклогексан тұзіледі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz