Әрекеттесуші массалар заңы: қышқыл-негіздік және комплекстік реакциялардың тепе-теңдігі



Әрекеттесуші массалар заңы арқылы реакциялардағы тепе-теңдікті сипаттау

Жоспар Қышқылдық-негіздік реакциялар. Протолиттік теория. Комплекстүзу реакциялары. Комплекс түзілу реакцияларындағы тепе-теңдік.
01
02
04
03
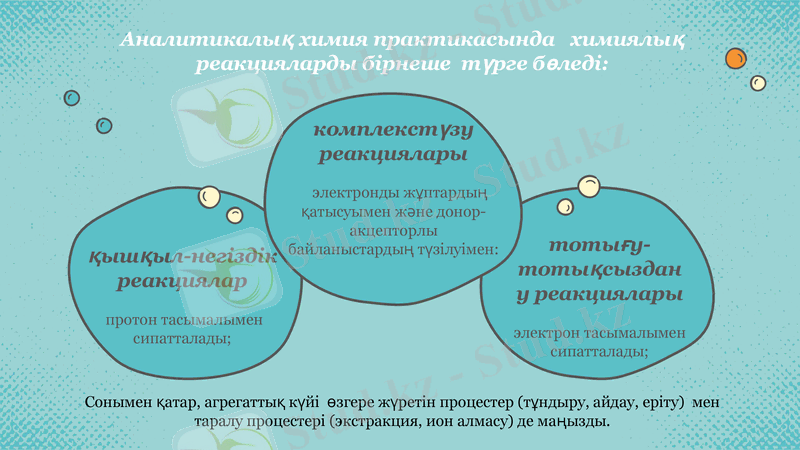
Аналитикалық химия практикасында химиялық реакцияларды бірнеше түрге бөледі:
қышқыл-негіздік реакциялар
протон тасымалымен сипатталады;
тотығу-тотықсыздану реакциялары
электрон тасымалымен сипатталады;
комплекстүзу реакциялары
электронды жұптардың қатысуымен және донор-акцепторлы байланыстардың түзілуімен:
Сонымен қатар, агрегаттық күйі өзгере жүретін процестер (тұндыру, айдау, еріту) мен
таралу процестері (экстракция, ион алмасу) де маңызды.

Аналитикалық химияда кездесетін құбылыстардың ауқымы Н. Бренстед пен Т. Лоуридің протолиттік теориясы тұрғысынан жақсы сипатталған (1923) . Протолиттік ілім бойынша, қышқылдар дегеніміз иондану нәтижесінде протондар түзетін, ал негіздер протонды қосып алатын қосылыстар. Протолиттік теория ілеспелі қышқылдар мен негіздер деген ұғымды енгізді. Протондардың ауысуымен сипатталатын реакцияларды протолиттік реакциялар деп, ал түзілетін тепе-теңдікті протолиттік тепе-теңдік деп атайды.
01

Аррениус теориясы
Қышқылдар мен негіздердің алғашқы теориялық концепциясы - ерітінділердегі заттардың электролиттік диссоциациялануына негізделген Аррениус теориясы.
Аррениус теориясы бойынша қышқылдар дегеніміз - сулы ерітіндіде диссоциацияланғанда H+ иондары түзетін заттар, HCl H+ + Cl-
ал негіздері - OH- иондары. NaOH Na+ + OH-
С. Аррениус ұсынған диссоциациялану ілімінің мәні мына қағидалармен сипатталады:
Тұздар, қышқылдар, негіздер молекулалары суда еріген кезде иондарға диссоциацияланады.
2. Иондар химиялық және электрохимиялық реакцияларға дербес бөлшектер сияқты қатысады.

- chemistry
“
Қазіргі көзқарас бойынша заттардың еруі екі процестен тұрады.
1) Бірінші - электролиттердің еруі: иондық кристаллды торы бар электролиттердің
еруі ( мысалы, KCl, NaCl, BaCl2), бұл жағдайда кристалдық торда орналасқан иондар ерітіндіге ауысады. Мұндай процесті диссоциациялану деп атайды.
2) Екіншіден- гетерополярлы молекулалардың еру процесі (H2S, HCl т. б. ) .
Молекулалардың бұл түрінің кристалдық торларында бос иондар жоқ. Мұндай молекулалардың еру процесін иондану деп атайды, себебі иондар тек еріткіште еру нәтижесінде пайда болады. Жалпы айтқанда диссоциация мен иондану арасында шекара жүргізуге болмайды. Бірақ коваленттік немесе гетерополярлы молекулаларының ерітінділерін қарастырғанда көбіне иондану ұғымын пайдаланады.
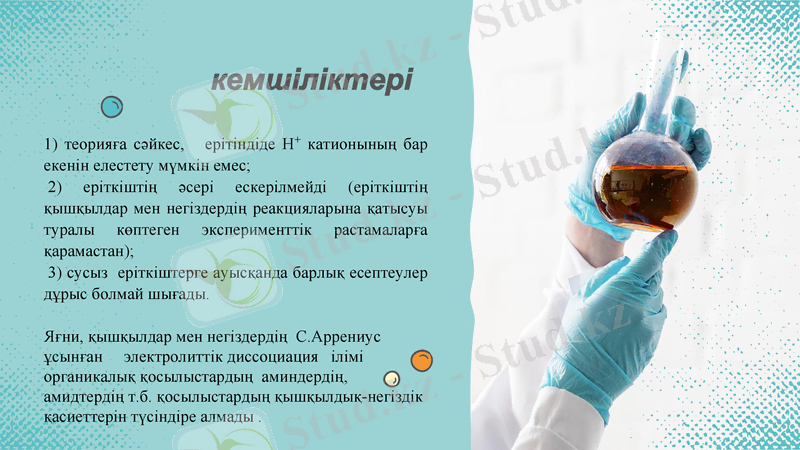
кемшіліктері
1) теорияға сәйкес, ерітіндіде Н+ катионының бар екенін елестету мүмкін емес;
2) еріткіштің әсері ескерілмейді (еріткіштің қышқылдар мен негіздердің реакцияларына қатысуы туралы көптеген эксперименттік растамаларға қарамастан) ;
3) сусыз еріткіштерге ауысқанда барлық есептеулер дұрыс болмай шығады.
Яғни, қышқылдар мен негіздердің С. Аррениус ұсынған электролиттік диссоциация ілімі органикалық қосылыстардың аминдердің, амидтердің т. б. қосылыстардың қышқылдық-негіздік қасиеттерін түсіндіре алмады .

Льюис теориясы
Бұл жағдайда ковалентті байланыстар түзіледі. Қышқыл класына сегіз электронды қабаты толтырылмаған атомдар түзетін молекулалар жатады (BF3, SO3), комплекстүзгіш катиондары (Fe3+, Cо2+ және т. б. ), қанықпаған байланыстары бар галогенидтер (TiCl4), поляризацияланған қос байланысы бар молекулалар (CO2, SO2) . Негіздер класы құрамына бос электрон жұптары бар молекулалар (NH3, H2O), аниондар, қос және үш байланысы бар органикалық қосылыстар, ароматты қосылыстар.
Бұл тәсіл органикалық химияда кең қолданылады (Льюис қышқылдары мен негіздері) . Алайда, аналитикалық химия тұрғысынан теория тым жалпылама болып шықты. Люис теориясында қышқыл-негіздік тепе-теңдігінің аналитикалық есептеулері үшін негіз болатын қышқылдар мен негіздердің күшін бағалаудың сандық критерийі жоқ, ол (мысалы, рН-ті бағалау үшін) .
Қышқылдар - электрондар жұбын қабылдайтын заттар
Негіздер - оны беретін заттар.

Қышқылдар мен негіздердің
ең жалпы теориясы - Усановичтің теориясы, оған сәйкес қышқылдар - катиондар беретін немесе аниондарды (немесе электрондарды) қабылдайтын заттар деп саналады, негіздер деп аниондарды (немесе электрондарды) беретін және катиондарды қабылдайтын заттар деп саналады. Көріп отырғанымыздай, Усановичтің қышқылдары мен негіздеріне Льюис қышқылдары мен негіздері, тотықтырғыштар және тотықсыздандырғыштар жатады.
Пирсон қышқылдарының теориясына сәйкес қышқыл (-электрон жұбының акцепторы ) негізбен (-электрон жұбының доноры ) өзара әрекеттесуі міндетті түрде ковалентті байланыс түзбейді, бірақ иондық және координациялық байланыстары пайда болуы мүмкін. Сонымен, қышқыл-негіз реакцияларының қатарына комплекстүзу реакциясы кіреді.
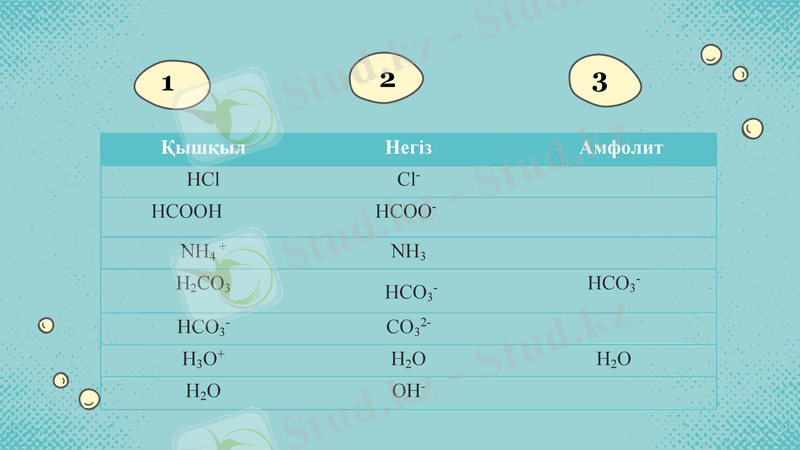
Қышқыл
Негіз
Амфолит
HCl
Cl-
HCOOH
HCOO-
NH4 +
NH3
H2CO3
HCO3-
HCO3-
HCO3-
CO32-
Н3О+
Н2О
Н2О
Н2О
ОН-
1
2
3

Протолиттік теория
Протолиттік теория сутегі иондарының сипаттамаларына негізделген. Протонның электрон қабығы жоқ; протонның мөлшері басқа иондардың мөлшерінен бес реттік кіші; протон өте мобильді. Протонды беруге қабілетті заттар қышқылдар деп аталады; негіздер - протон қабылдауға қабілетті заттар. Протонның доноры да, акцепторы да бола алатын заттар бар, оларды амфолиттер деп атайды. Қышқылдар, негіздер мен амфолиттер зарядталмаған және зарядталған бөлшектер болуы мүмкін

Протон р-ның HA қышқылынан В негізіне ауысуымен жүретін қайтымды реакциялар қышқыл-негіздік жартылай реакциялар деп аталады:
Қышқыл мен бір протонды беру кезінде пайда болған негіз ілеспелі жұп құрайды. (5. 1), (5. 2) теңдеулерде бұл HA және A-, BH+ және B бөлшектері. Әрине, ерітінділердегі (5. 1), (5. 2) реакциялар бөлек болуы мүмкін емес: қышқыл протонды тек протон акцепторы қатысқан жағдайда бере алады. Барлық заттар тек қышқылдар немесе негіздер болуы мүмкін; олар қышқылдық немесе негіздік қасиеттерін жартылай реакцияларды (5. 1), (5. 2) біріктіретін протолиттік реакцияда ғана көрсете алады:
қышқыл 1 негіз 2 қышқыл 2 негіз 1

Қышқылдық та және негіздік те қасиеттері бар амфипротикалық (амфипротты) еріткіштер: су, спирттер, карбон қышқылдары, біріншілік және екіншілік аминдер. Кейде протогендік деп аталатын еріткіштер класы ажыратылады; бұл қышқылдық қасиеттері негіздік қасиеттеріне қарағанда басым болатын амфипротты еріткіштер (мысалы, сусыз H2SO4) .
Протолиттік реакцияның құрамдас компонентінің бірі еріткіш болуы мүмкін. Қышқыл-негіздік қасиеттері тұрғысынан еріткіштерді үш топқа бөлуге болады.
Қышқылдық та және негіздік те қасиеттері болмайтын апротонды еріткіштер; мысалы, көмірсутектер және олардың галоген туындылары: бензол, гексан, тетрахлорметан.
Тек негіздік қасиеттерге ие протофильді еріткіштер: кетондар (ацетон), жай эфирлер (диоксан, диэтил эфирі), үшінші реттік аминдер (пиридин) .

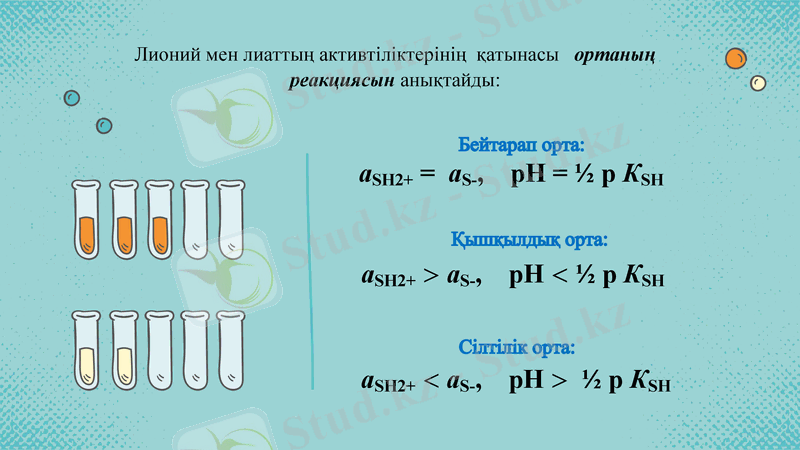
Лионий мен лиаттың активтіліктерінің қатынасы ортаның реакциясын анықтайды:
aSH2+ = aS-, pH = ½ p КSH
Бейтарап орта:
Қышқылдық орта:
Сілтілік орта:
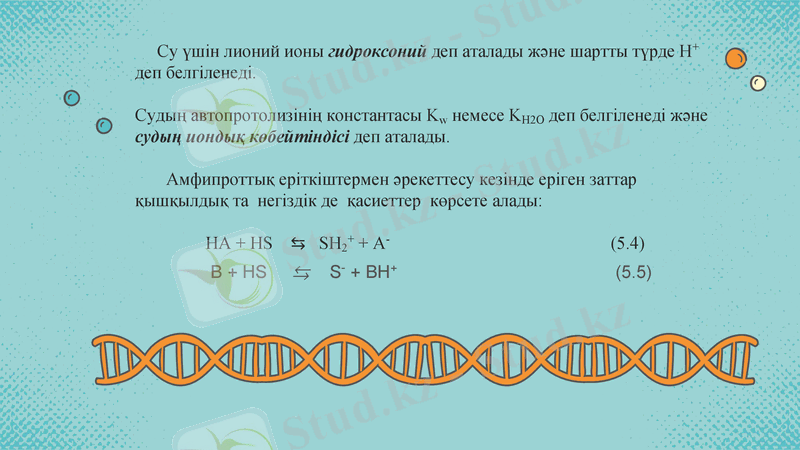
Су үшін лионий ионы гидроксоний деп аталады және шартты түрде H+ деп белгіленеді.
Судың автопротолизінің константасы Kw немесе KH2O деп белгіленеді және судың иондық көбейтіндісі деп аталады.
Амфипроттық еріткіштермен әрекеттесу кезінде еріген заттар қышқылдық та негіздік де қасиеттер көрсете алады:
HA + HS ⇆ SH2+ + A- (5. 4)
B + HS ⇆ S- + BH+ (5. 5)

HA және B заттарын зарядталған және зарядталмаған болуы мүмкін; мысалы суда:
HNO2 + H2O ⇆ H3O+ + NO2-
NH4 + + H2O ⇆ H3O+ + NH3
NH3 + H2O ⇆ OH- + NH4 +
CH3COO- + H2O ⇆ OH- + CH3COOH
Сусыз еріткіштерде, мысалы құмырсқа қышқылы мен метанолда тепе-теңдік жүзеге асырылады:
NH3 + HCOOHсусыз ⇆ NH4+ + HCOO-
NH4+ + CH3OНсусыз ⇆ CH3OН2+ + NH3
HCOOHсусыз, CH3OНсусыз - сусыз еріткіштер

Қышқылдың протонды беретін, ал негіздің оны қабылдайтын қабылетін тепе-теңдік константаларымен сипаттайды, оларды қышқылдық константасы Кa және негіздік консантасы Кb деп атайды.
Еріткіш активтілігінің тұрақтылығын ескере отырып,
Коa = aSH2+ aА- / aНА (5. 7)
Коb = aBH+ aS- / aB
Cоңғы кезде протондалу константасы қолданылуда Kh = 1/Ka.
Бірақ, көбіне практикада диссоциациялану реакциясына негілделген Кa және Кb тепе -теңдік константалары қолданылады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz