Кешенді қосылыстар мен гемоглобин: құрылым, изомерия және медицинадағы темірлі препараттар



Тақырыбы: Гемоглобин және құрамында темірі болатын препараттар.
Химиялық пәндер кафедрасы
СӨЖ
Орындаған:Түзел Бағдаулет
Группа:фкб 03-20
Қабылдаған:Туребекова Г. А.
Шымкент 2020-2021 ж.

Жоспар:
1. Кешенді қосылыстар. Вернердің координациялық теориясының негізгі қағидалары
2. Комплексті қосылыстар жіктелуі, номенклатурасы, тұрақтылығы, изомериясы
3. Медицина мен фармацияда қолданылуы
Қорытынды
Пайдаланылған әдебиеттер

Кешенді қосылыстар координациялық қосылыстар-жай химиялық қосылыстардың әрекеттесуі нәтижесінде түзілетін құрамы күрделі химиялық қосылыстар. Кешенді қосылыстарға кристаллогидраттар CuSO4*H2O, аммиактар CaSO4*4NH3, ашудас KAI(SO4) 2*12H2O, т. б күрделі қосылыстар жатады. Кешенді қосылыстар теориясын алғаш (1893) Швейцария химигі А. Вернер ұсынды және оны координациялық теория деп атады.
Кешенді қосылыстар
А. Вернер координациялық теориясы

Координациялық теорияның негізгі қағидалары:
КҚ орталық орын алып тұрған ион немесе атом комплекс түзуші деп аталады.
Комплекс түзушінің айналасына соның әсері жететіндей жақындықта координацияланған иондарды немесе молекулаларды лигандалар (аддентер) деп атайды.
Комплекс түзуші мен лигандалар бірігіп, комплексті қосылыстың ішкі сферасын құрайды.
Ішкі сфераны квадрат жақшаға алады: [ PtCl6 ] 2-
Ішкі сфераға орналаспай қалған иондар комплекс түзушіден алысырақ орналасады, олар комплексті қосылыстың сыртқы сферасын құрайды.
Комплекс түзушінің айналасына координацияланған лигандтардың жалпы саны сол комплекс түзушінің координациялық саны деп аталады.
Жиі кездесетін комплексті қосылыстарда координациялық сан алтыға немесе төртке тең, сирек екіге, не үшке тең болады.

КҚ ЖІКТЕЛУІ
I. Комплекстер ішкі сферасының зарядына қарай катионды, анионды және бейтарап болып үш топқа бөлінеді.
Катионды комплекстер орталық ионның айналасына бейтарап молекулалар (NO, NH3, H2O) координацияланғанда түзіледі.
[Al(H ₂O) ₆] Cl₃ [Al(H ₂O) ₆] ³⁺ +3Clˉ
Комплексті иондар оң зарядталған.
Анионды комплекстерде комплекс түзушінің ролін оң зарядталған ион, ал лигандтар ролін аниондар атқарады.
К[ Аg(CN) 2] [ Аg(CN) 2] - + К+
Бейтарап комплекстер атомының айналасында молекулалар координацияланғанда немесе оң зарядталған комплекс түзушінің айналасында анион мен молекулалар қатар координацияланғанда түзіледі [ Fe ( CO) 5 ]

II. Лигандтың табиғаты бойынша КҚ бөледі:
Аммиакаттар - КҚ ішікі сферасында лиганд ретінде NH3 молекуласы бар.
Аквакомплекстер - КҚ лигандттар су молекулалары болады.
Гидроксокомплекстер - лигандалары ОН-
тобы
Ацидокомплекстері - лигандалары қышқыл қалдығы.
Аралас комплекстер - лигандалары аралас.

III. Ішкі сферасының құрылысы бойынша
Комплекс түзуші иондар санына қарай бір ядролы және көп ядролы комплекстер
Жай және циклі бар комплекс, сақиналары бар комплекс. Егер бір лиганда бір координациялы орын алса, оны жәй комплекстер дейді.
Циклді немесе хелатты комплексті лигандтар полидентантты(хелаттарға комплексондар жатады СН2-NH2 H2N -CH2
Cu
СН2-NH2 H2N-CH2

КҚ номенклатурасы
1962 жылы химиктердің Халықаралық Одағы (ІUPAC) ұсынған номенклатурасы қолданылады.
Теріс зарядты лигандтардың атауына «О» деген жалғау жалғанады СI- хлоро-, СN- циано-.
Электробейтарап лигандтар былай аталады:
H2O-аква NH3-аммин CO-карбонил NO-нитрозил
OH-гидроксо O-окси т. б.
Комплекс құрамындағы лигандтардың саны грек сан есімдерімен белгіленеді:
ди (екі), три (үш), тетра(төрт), пента (бес), гекса (алты) т. б.

Медицина мен фармацияда қолданылуы
Биокомплекстік қосылыстар тұрақтылығы бойынша ажыратылады. Олар- дың кейбіреуінің тұрақты болғаны сонша, олар әрқашан да ағзада болып, белгілі бір функцияны атқарып тұрады.
Құрамына металл ионы кіретін көптеген ферменттер тірі ағзада келесі қызметтер атқарады:1) Олар ферменттердің активті орталығының электрофильді тобы болып келеді және субстрат молекулаларының теріс зарядталған бөліктерімен әсерлесуге мүкіндік береді.
Металл ионы фермент құрылымының каталитикалық активті коыормациясын қалыптастырады.
Кейде түрлі тотығу дәрежесін көрсететін метал иондары электрондар тасымалдауына қатысады.

КҚ изомериясы
Изомерлер- құрамдары бірдей, бірақ құрылысы мен қасиеттері әртүрлі заттар. Изомерия құбылысы комплексті қосылыстарда өте кең таралған
Гидраттық немесе сольватты изомерия су молекуласының комплекс құрамында әртүрлі орналасуынан болады.
[Сr(Н2О) 6] Сl3, [Сr(Н2O) 5Сl] Сl 2*Н2O, [Сr(Н2O) 4Сl2] Сl *2Н2O
күлгін түсті күлгін-жасыл жасыл
Иондық изомерия аниондардың ішкі сфера мен сыртқы сфераға әртүрлі таралуынан болады.
[Pt(NH3) 3Br] NO2 және [Pt(NH3) 3(NO2) ] Вr

Координациялық изомерия - екі түрлі лигандтардың екі комплекс түзушінің айналасына әртүрлі жолмен координациялануынан болады.
[Co(NH3) 6] [Cr(C2O4) 3] и [Cr(NH3) 6] [Co(C2O4) 3 ]
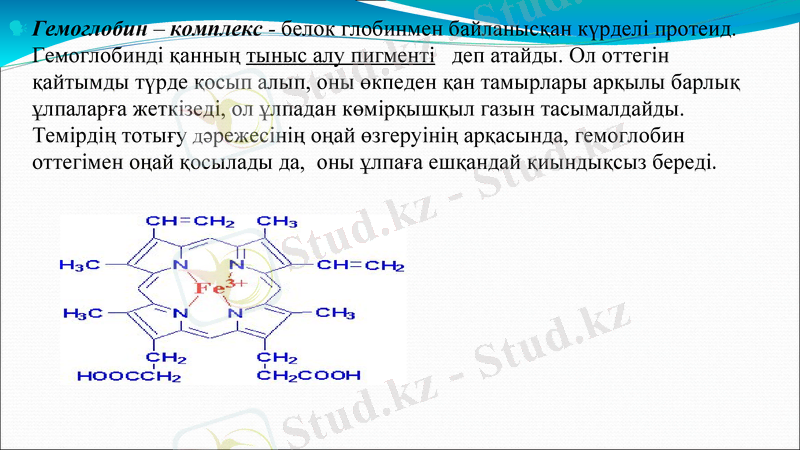
Гемоглобин - комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу дәрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді.
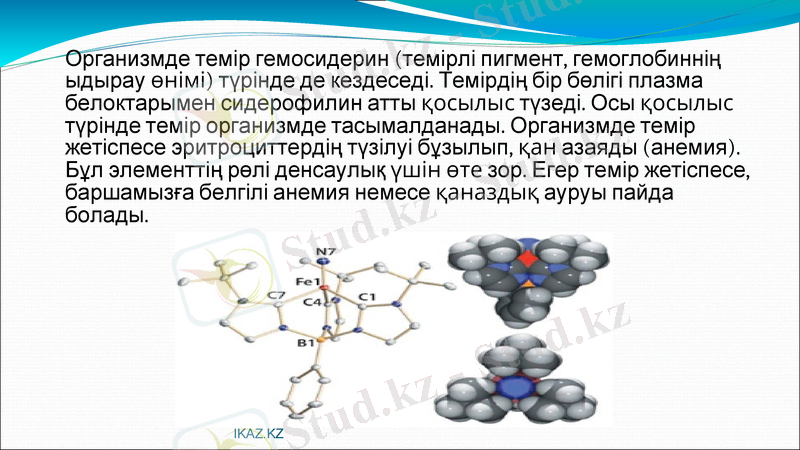
Организмде темір гемосидерин (темірлі пигмент, гемоглобиннің ыдырау өнімі) түрінде де кездеседі. Темірдің бір бөлігі плазма белоктарымен сидерофилин атты қосылыс түзеді. Осы қосылыс түрінде темір организмде тасымалданады. Организмде темір жетіспесе эритроциттердің түзілуі бұзылып, қан азаяды (анемия) .
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz