Комплексонометрлік титрлеу және ЭДТА көмегімен судың кермектігін анықтау



Тақырыбы: Комплексонометрлік титрлеу. Судың кермектілігін анықтау.
Орындаған: Алибай А
Тобы: 203 «А» ФӨТ
Қабылдаған:Дильдабекова Л
Оңтүстік Қазақстан Медицина Академиясы Химиялық пәндер кафедрасы ПРЕЗЕНТАЦИЯ

Жоспар

Комплексонометриялық талдау әдісі
Аз иондалатын кешенді иондардың (немесе молекулалардың) түзілуіне негізделген титриметриялық анықтауларды біріктіреді.
Катиондардың органикалық реактивтермен - комплексондармен әрекеттесуге негізделген талдау әдістерін комплексонометриялық деп атайды.

Комплексонометрлік титрлеу әдісінің негізі
Комплексондар дегеніміз - полиаминополикарбон қышқылдары.
Комплексонометрлік титрлеу әдісінің сезімталдығы жоғары (10-3моль/дм3), дәл қарапайым және тез орындалады.

Аналитикалық химияда комплексон-I, II және III түрлері жиі қолданылады:

Company Logo

ЭДТА-ның құрамы, тұрақтылығы және жұмысшы ерітіндісін дайындау
Комплексон-III титрлеуде жиі қолданылады. Егер, оның қысқаша формуласы Na2H2Y деп белгілесек төмендегіше ионға диссоциацияланады:
Na2H2Y= 2Na++H2Y2
Түзілген Н2Y2- анионы, анықталуға тиісті металл иондары Ме2+, Mе3+ және Mе4+мен төмендегімен әрекеттесіп хелаттар түзеді:
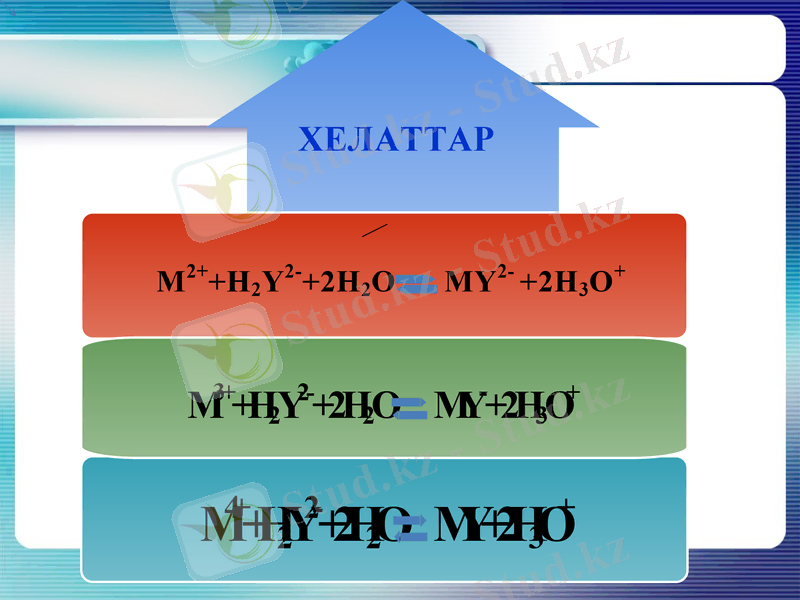
ХЕЛАТТАР

Теңдеулерден көріп отырғанымыздай, комплексон-III-тің әр молекуласы бір катионмен (тотығу дәрежесіне тәуелсіз) ғана әрекеттеседі. Демек, әрекеттесуші заттар үшін эквивалент факторы (fэкв) бірге тең.

Ca2++H2Y= CaY2-+2H+
Bi3++H2Y2-=BiY-+2H+
Zr4++H2Y-=ZrY+2H+
мысалы

Кешенді қосылыстарға басқа тәсілдермен айналдыруы қиын сілтілік металдармен (Ca2+, Mg2+, Ba) комплексон III ішкі кешенді тұздар түзеді, сондықтанда химиялық талдауда кең қолданылады.

Комплексонометриялық
титрлеудің индикаторлары
ЭДТА-ны титрант ретінде қолданылған алғашқы титриметриялық әдістерде қышқылдық-негіздік индикаторлар пайдаланылған себебі ЭДТА-ның артық мөлшері металл тұзының бейтарап ерітіндісіне қосылады да реакция нәтижесінде тиісті мөлшерде бөлініп шыққан сутек иондары титрленген.

Комплексонометрияның қарқынды дамуы металлохромды дамуы индикаторлардың ашылуы мен байланысты. Бұл заттар металл иондарымен әрекеттескенде боялған қосылыстар түзеді, бірақ комплексонаттарға қарағанда беріктігі төмендеу. Металл иондарымен комплекс түзетін индикаторларды бос иондардан немесе индикатор молекулаларынан түсі бойынша ажыратады.

Комплексонометрлік анықтау үшін индикатор ретінде кейбір трифенилметандық бояғыштарды қолданады. Көптеген катиондарды (Zr4+, Th4+, Bi3+, Fe3+) ксиленолды сарғыш қызыл, металфталеин, метилтимолды көк, пирокатехинді күлгін бар болғанда титрлейді

Комплексонометрияда сондай-ақ арнайы реактивтерді қолданады, олар талданатын иондармен боялған қосылыстар түзеді, мысалы, сульфосалицил қышқылы немесе Fe3+үшін тиоционат, Bi3+үшін тиомочевина және басқалар.

Судың кермектігі
Судың кермектігі- құрамында еритін Са2+ және Mg2- тұздарының, гидрокарбонаттардың, сульфаттардың және хлоридтердің болуына негізделген, табиғи судың қасиеті.
Кермектіктің екі түрін ажыратады: карбонатты және карбонатсыз.
Карбонатты кермектікті (уақытша немесе жойылатын) Ca(HCO3) және Mg(HCO3) 2 гидрокарбонаттарының мөлшерімен анықталады. Қайнатқан кезде бұл тұздар тұнба болып түсетін CaCO3 және MgCO3 бөліп, ыдырайды және су жұмсарады.

Қаттылық шамасы бойынша табиғи сулар былай бөлінеді:
өте жұмсақ - 1, 5 мг-экв дейін;
жұмсақ - 1, 5-30 мг-экв;
орташа қатты - 3-6 мг-экв;
қатты - 6-9 мг-экв;
өте қатты - 9 мг-экв жоғары.
Орталықтан сумен қамтамасыз ету көзінің суының жалпы қаттылығы 7 мг-экв/л аспау керек.

Судың кермектігін анықтауда қолданылуы
Судың жалпы кермектігін анықтау.
Техникалық, агрохимиялық талдау тәжірибесінде, тамақ өнеркәсібінде және халық шаруашылығының басқа салаларында су кермектігін комплексонометриялық анықтауды жиі қолданады, оны 1 л судағы Са және Mg-нің ммэкв-қосындысы санымен сипаттайды.

Талдау жасау үшін зерттелетін суды аммоний буферлі қоспамен pH=10 болғанша сілтілендіреміз. Индикатор ретінде арнайы хромоген қара ЕТ-00 ерітіндісін пайдаланады, ол Ca2+ және Mg2+ иондарымен шарап қызыл түсті ерімтал кешендер түзеді:

Ca2+ + Hlnd2+=Calnd- + H+ :
шарап-қызыл
Mg2+ + Hlnd2+=Mg lnd- + H+
шарап-қызыл
1) KCalnd-=3. 9*10-6
2) KMglnd-=1*10-7

Ca2+ және Mg2+ ЭДТА-мен тұрақсыздық константалары едәуір төмен (2, 7*10-11 және 2*10-9) . Сондықтан ЭДТА ерітіндісіен титрлегенде, ол тисті кешендерден индикаторды ысырып шығарып, одан да берік кешендер түзеді.
Сонымен зквивалент нүктесінде ерітіндінің шарап-қызыл түсі көкке ауысады.

Комплексонометрлік титрлеу фармацияда мырыш препараттарын: мырыштың сульфатын және оксидін; кальций препараттарын; хлоридін, глюконатын, кальций лактатын; магний сульфатын анықтауда қолданылады. Комплексонометрлік титрлеу суға талдау жасауда оның кермектілігін анықтауда қолданылады.
Әдістің қолданылуы

Пайдаланылған әдебиеттер
CRC Handbook of Chemistry and Physics / D. R. Lide (Ed. ) . - 90th edition. - CRC Press; Taylor and Francis, 2009. - 2828 p. - ISBN 1420090844.
↑ Перейти обратно:1 2 3 http://www. cdc. gov/niosh/npg/npgd0439. html
↑ // Химическая энциклопедия
https://www. sgu. ru/sites/default/files/textdocsfiles/2014/01/11/se_ar. pdf
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz