Күшті және әлсіз электролиттер: ерітіндідегі иондық концентрация мен диссоциациялану дәрежесін анықтау



ПРЕЗЕНТАЦИЯ
«Оңтүстік Қазақстан
медицина акдемиясы» АҚ
АО «Южно-Казахстанская
медицинская академия»
Орындыған:Абылаева. А
Тобы:106-ФӨТ-ҚБ
Қабылдаған:Бухарбаева. А
Шымкент 2019
Тақырыбы:Күшті және әлсіз электролиттер. Әлсіз электролит ерітінділердің иондарының концентарациясын және диссоциялану дәрежесін анықтау

Жоспар
Кіріспе
Негізгі бөлім
Күшті электролиттер
Әлсіз электролиттер
Электролиттік диссосация
Диссоциялану дәрежесі
Қорытынды
Қолданылған әдебиеттер

Электролиттер ( грек. lysіs - еру, ыдырау) - еріген немесе балқыған күйде электр тогын өткізетін заттар. Электролиттерге қышқыл, негіз, тұздың судағы ерітінділері жатады; бұларда электр тогы иондар арқылы тасымалданады. Электролит ерітінділерінен ток өткенде электродтарда тотығу-тотықсыздану процестері - электролиз жүзеге асады. Электролиз Фарадей заңдарына сәйкес жүреді, ол таза металдар, хлор, күшті сілтілер алуда кеңінен қолданылады. Диссоциациялану дәрежесіне қарай Электролит әлсіз (3%-ға дейін) және күшті (30%-дан артық) болып екі негізгі топқа бөлінеді.
ЭЛЕКТРОЛИТТЕР
Күшті
электролиттер
Әлсіз
электролиттер

Күшті электролиттер деп еріген немесе балқыған кезде толық диссоциацияланатын, яғни толығымен иондарға ыдырайтын электролиттерді айтады.
Электролиттердің классикалық ілімі - Аррениус ілімі 2 ғасыр бойы электролиттердің жалпы ілімі деп есептелген. 1923 жылы Гюккель және Дебаймен электролит ерітінділерінің электрстатикалық ілімі деп, ал қазіргі кезде күшті электролиттер ілімі деп аталатын жаңа ілім басылған.
Ілімнің негізгі қағидалары:
1. Күшті электролиттер еріген немесе балқыған кезде толығымен диссоциацияланады. Сондықтан диссоциацияның шынайы дәрежесі
2. Электролиттің толық диссоциациялануына байланысты ерітіндіде иондардың көп саны болады, сондықтан электростатикалық әрекеттесу күштерін ескермеуге болмайды.
3. Көптеген тәжірибелер арқылы күшті электролит ерітінділерінде диссоциацияланбаған молекулалар жоқ болатындығын анықтаған, бірақ еріткіштің иондары мен молекулалары түзетін бейтарап комплекстер бар болады. Сондықтан күшті электролит ерітінділері әрекеттесуші массалардың II заңына бағынбайды.

4. Күшті электролит ерітінділері нақты ерітінділер болып табылады. Сондықтан олар идеал ерітінділердің заңына бағынбайды, яғни бұл ерітінділер эффективті концентрация, яғни активтікпен сипатталады.
5. Күшті электролит ерітінділері үшін активтік коэффициенті тұрақты шама болып табылмайды. Олар өз кезеңінде концентрацияға байланысты болады.
Бірақ, Гюккеля-Дебаядың ілімі электролиттердің тек сұйытылған ерітінділерін жақсы сипаттайды. Сондықтан, Гюккеля-Дебай ілімін баян еткенде келесі шектеулер еңгізілген:
1. Иондар нүктелік зарядтар ретінде қарастырылады, яғни олардың өлшемдері ескерілмейді.
2. Электрондық бұлттар да нүктелік зарядтар ретінді қарастырылады, яғни зарядтар орталық ион айналасында біркелкі жағылған.
3. Тек қана электростатикалық әрекеттесу күштері ескеріледі. Басқа күштер ескерілмейді.

Әлсіз электролиттер ілімі. Әлсіз электролитер ілімі - Аррениус ілімі.
1. Әлсіз электролиттер еріген немесе балқыған кезде диссоциацияланады.
2. Диссоциация ішін-ара өтеді: диссоциация дәрежесі
3. Осындай диссоциация дәрежесінде ерітіндіде иондардың бар болуы айтарлықтай аз, сондықтан өзара әрекеттесу күштерін ескермеуге болады, өйткені әрбір ион ерітікіш молекулаларының артық санымен қоршалған.
4. Әлсіз электролиттер ерітінділері идеалды сұйытылған ерітінділер болып табылады.
5. Әлсіз электролиттер ерітінділері идеалды сұйытылған ерітінділерінің барлық заңдарына бағынады
6. Әлсіз электролиттер ерітінділері ӘМЗ II заңына бағынады. Мұнда тепе-теңдік константасы диссоциация константасы болып саналады:

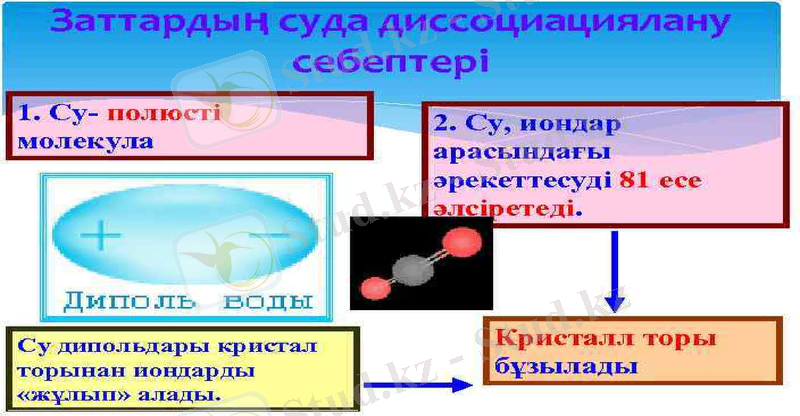
Электролиттер сәйкес еріткіштерде қарама-қарсы зарядталған бөлшектерге, иондарға диссоциацияланады. H 2 SO 4 → H+ + HSO- 4 HSO 4 → H+ + SO 42 KOH → K+ + OH- Al. OHSO 4→ Al+3 + OH- + SO 2 -4 Иондардың арасында әрекеттесу күштері болмайды. Сондықтан олардың ерітінділері өздерін идеал газ жүйелері сияқты ұстайды. Электролиттік диссоциация теориясы электролит ерітінділерінің Вант-Гофф және Рауль заңдарынан ауытқу себебін түсіндіргенімен, электролиттердің химиялық қасиеттерінің ерекшеліктерін түсіндіре алмады. Оларды түсіндіруге талпынып, И. А. Каблуков 1891 жылы гидратты теорияны ұсынды.

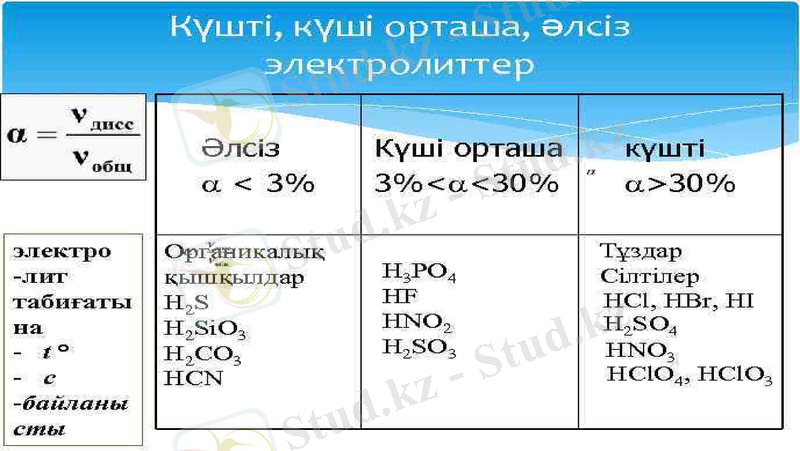
Диссоциациялану үдерісін сандық жағынан да сипаттауға болады. Диссоциацияланудың қаншалықты толық жүретіндігін диссоциациялану дәрежесі (α) көрсетеді, α-ны сандық үлеспен (0 -1) немесе пайызбен (0100%) беруге болады. α = диссоциацияланган молекулалар саны/жалпы еріген молекулалар саны Диссоциациялану дәрежесінің мәніне қарай электролиттер үш топка бөлінеді: α > 30% - күшті; 3% < α < 30% - орташа күшті; α < 3% - әлсіз.
Диссоциация лану дәрежесіне заттың және еріткіштің табиғаты, ерітіндінің концентрациясы, температура әсер етеді. c 1=c • α • n Мұндағы: c 1 - ерітіндідегі иондар концентрациясы; с - заттың молярлы концентрациясы; α - диссоциациялану дөрежесі; n - ерітіндіге өтетін иондардың моль саны.
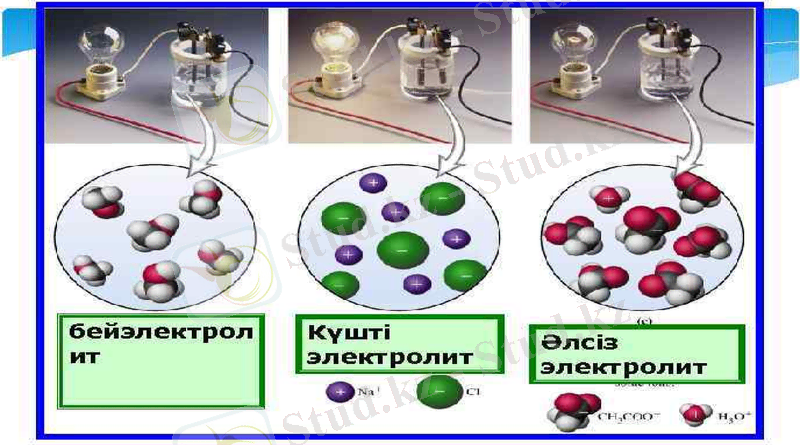




1. Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы.
2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар) .
3. Диссоциация - қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді. (ассоциация)


Диссоциациялану дәрежесі - диссоциацияланган молекулалар санының ерітіндідегі жалпы молекулалар санына қатынасы. Ол процентпен көрсетіліп, мынадай формуламен өрнектеледі
α=n/N x100
Мұндағы n - диссоциацияланатын молекулалар саны, N - барлық молекулалар саны.
Диссоциациялану дәрежесін процентпен көрсету үшін оның шамасын 100-ге көбейтеді. Мысалы, электролиттің диссоциациялану дәрежесі 60% болса, бұл оның 100 молекуласының 60-ы иондарға ыдырағанын білдіреді.
Электролит молекуласындағы атомдар арасындағы байланыстың беріктігіне карай диссоциацияланған молекулалар саны диссоциацияланбаған молекулалар санынан не көп, не аз болуы мүмкін. Электролит молекуласындағы байланыс әлсіз болса, диссоциацияланған молекулалар саны көп болады. Керісінше байланыс берік болғанда, иондарға айналатын молекулалар саны аз болады.
Электролиттің қандай мөлшерде диссоциацияланғанын көрсететін шама - диссоциациялану дәрежесі деп аталады және α (альфа) әрпімен белгіленеді.

Қорытынды
Айта кететін жағдай, тамаққа қосылатын қышқылдар - сірке қышқылы, лимон қышқылы, алма қышқылы, сол сияқты дәрі ретінде қолданылатын бор қышқылы, ацетилсалицил қышқылы (аспирин) әлсіз электролиттерге жатады. Судың диссоциациялану дөрежесі (бөлме температурасында) =10~9, яғни бір миллиард молекуладан біреуі ғана диссоциацияланады. Сондықтан оның диссоциациялану теңдеуін жазбай молекула түрінде бейнелейді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz