Қазақстан Республикасының Мемлекеттік фармакопеясы: қалыптасуы, құқықтық негізі және дәрі-дәрмектер сапасын қамтамасыз ету рөлі



ҚР Білім және ғылым министрлігі Е. А. Бөкетов атындағы Қарағанды университеті Химия факультеті
Тақырып: Қазақстан Республикасының Мемлекеттік фармакопеясы
Орындаған: Бархат Гулнур Қабылдаған: Садвакасова Л. Е. Топ: ТФП-312

Қалыптасқан тарихи жағдайларда ұлттық фармакопеялық стандарттарды жасауды Мемлекет басшысы қоғам денсаулығын сақтау мақсатында уақыттың өзекті талабы ретінде айқындады. Алғаш рет ҚР МФ құру қажеттілігі Қазақстан Республикасы Президентінің 1995 жылғы 23 қарашадағы № 2655 "дәрілік заттар туралы" заң күші бар Жарлығымен айқындалды. Ұлттық фармакопеялық стандарттарды әзірлеу мәселесін одан әрі дамыту "дәрілік заттар туралы" 2004 жылғы 13 қаңтардағы № 522-II ҚР Заңында көрініс тапты.
Ұлттық фармакопеялық стандарттар болмаған кезде республикада дәрілік заттар сапасын мемлекеттік бақылауды дамытудағы маңызды қадам әлемнің негізгі фармакопеялары - Еуропалық фармакопеяны, Британдық фармакопеяны, АҚШ фармакопеясын және неміс гомеопатиялық фармакопеясын тану болды (ҚР ДСӘДМ Фармация, фармацевтика және медицина өнеркәсібі комитетінің 2004 жылғы 11 ақпандағы №21 "ҚР аумағында халықаралық фармакопеяларды тану және дәрілік заттарды сыныптау туралы"бұйрығы) .

ҚР МФ құру мемлекеттік қолдаумен 2005 жылдан бастап жүзеге асырылады. Фармакопеяның бірінші басылымы үш томдық мемлекеттік (қазақ) және орыс тілдерінде жарияланды I және II томдар бекітілді және 2008 жылы, III том - 2015 жылы қолданысқа енгізілді. ҚР МФ заңнамалық мәртебесі "Халық денсаулығы және денсаулық сақтау жүйесі туралы" ҚР Кодексімен белгіленген.

ҚР МФ әзірлеуші ұйым ҚР ДСӘДМ "Дәрілік заттарды, медициналық мақсаттағы бұйымдар мен медициналық техниканы сараптау ұлттық орталығы" ШЖҚ РМК (бұдан әрі - ұлттық орталық) болып табылады. Ұлттық орталық фармакопеялық және реттеуші органдарда жаһандық деңгейде ҚР МФ ұсынады. Ұлттық фармакопеялық стандарттарды дамыту және оларды ЕАЭО шеңберінде үйлестіру мақсатында оның құрылымында ҚР МФ мен ЕАЭО фармакопеясын әзірлеу және жетілдіру орталығы құрылды. Орталық құрамында фармакопеялық монографиялар жобаларын қарауға және мақұлдауға, сондай-ақ фармакопеялық стандарттау саласындағы кез келген мәселелерді шешуге арналған фармакопеялық комиссия жұмыс істейді.

МФ мағнасы мен мақсаты
Фармакопеялардың бүкіл әлемде жұмыс істеуі олардың миссиясымен анықталады. Барлық жағдайларда оның тұжырымдамаларындағы айырмашылық негізінен бір нәрсеге әсер етпейді-олардың қауіпсіздігін, тиімділігі мен сапасын қамтамасыз ететін дәрі-дәрмектер сапасының мемлекеттік стандарттарын құру арқылы қоғамның денсаулығын қорғау. ҚР МФ миссиясына да дәл осындай мағына берілген, оның мақсаттарына шынайы ізгілікті сипат берілген.

ҚР МФ талаптары әлемнің көптеген фармакопеялары сияқты дәрілік заттарға ғана емес, медициналық мақсаттағы бұйымдарға да қолданылады. Осыған байланысты, ҚР МФ бастапқы анықтамасы медициналық практикада қолданылатын құралдардың көрсетілген санатын қамтитын өзгерістерге ұшырады. Осылайша, ҚР МФ дәрілік заттар мен медициналық мақсаттағы бұйымдардың сапасын нормалайтын мемлекеттік стандарттар мен ережелер жиынтығын білдіреді.

ҚР МФ дәрілік заттарды стандарттау жүйесінде орталық орын алады. Фармакопея мемлекет кепілдік беретін дәрілік заттар сапасының шекті рұқсат етілген деңгейін белгілейді. Өндірушілердің сипаттамасымен реттелетін сапа деңгейі фармакопеялық талаптардан төмен болмауы керек, бірақ тіпті қатаң болуы керек. Өндірушінің өзіндік ерекшелігінің негізінде уәкілетті органмен келісім бойынша оның өмірлік циклінің барлық сатыларында сапаны бақылауға арналған дәрілік заттың сапасы жөніндегі нормативтік құжат жасалады. Осылайша, фармакопеяның талаптары дәрі-дәрмектердің толық өмірлік циклін қамтиды. Ұқсас жұмыс істеу тетігі дәрілік заттардың сапасын мемлекеттік реттеудің басты құралы ретінде ҚР МФ рөлін айқындайды (1-сурет) .
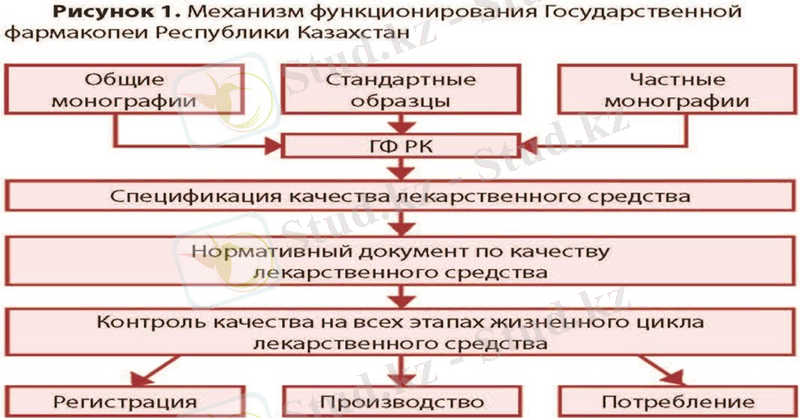

Фармакопея тиісті фармацевтикалық тәжірибелермен (GхP) тығыз байланысты. Тиісті фармацевтикалық практикалар дәрілік нысанның әрбір бірлігі үшін сериядан серияға фармакопея талаптарына сәйкестікті қамтамасыз етуге арналған. Екінші жағынан, фармакопея талаптарын орындау қажеттілігі дәрілік заттар айналымы саласында GхP енгізуді және тұрақты ұстауды ынталандырады. Тиісті фармацевтикалық практикалармен қатар ҚР МФ отандық фармацевтикалық өнімдердің бәсекеге қабілеттілігі мен экспортқа бағдарлануын қамтамасыз етудің маңызды факторы болып табылады. Оған ҚР МФ-ның әлемнің негізгі фармакопеяларымен үйлесуі де айқындаушы дәрежеде ықпал етеді.

Әлемнің негізгі фармакопеяларының стандарттарымен үйлестіру ҚР МФ құрудың негізіне алынған басты қағидат болып табылады. Ұлттық фармакопеялық стандарттарды әзірлеу тәжірибесін алу үшін республика әлемнің жетекші фармакопеялық ұйымдарына, мысалы, Еуропа кеңесінің еуропалық фармакопеялық комиссиясына байқаушы ел ретінде (2006 жылғы маусым), АҚШ фармакопеялық конвенциясына алдымен байқаушы ел ретінде (2009 жылғы шілде), содан кейін толық құқықты мүше ретінде (2010 жылғы қараша) кіру бойынша бірқатар маңызды қадамдарды жүзеге асырды.

Фармакопеялық стандарттау тәжірибесінен басқа, әлемнің жетекші фармакопеялық ұйымдарындағы бақылаушы елдің немесе мүше елдің мәртебесі мынадай міндеттерді шешуге мүмкіндік береді:
осы саладағы ұлттық тәсілдер мен даму жолдарын анықтау;
әлемнің негізгі фармакопеяларының талаптарымен үйлестіру мүмкіндігі;
сараптамалық топтарды жұмысқа тарту;
білім беру немесе ғылыми бағдарламаларға қатысу;
сынақ зертханаларын аккредиттеу және олардың Еуропа Кеңесінің дәрілік заттардың сапасын бақылаудың ресми зертханалары желісіне (OMCLGEON) кіруі) ;
жаһандық фармакопеялық қызметке қосу (мысалы, жаһандық фармакопеялық индексті құру, ДДҰ басшылығын дайындауға қатысу "тиісті фармакопеялық практика" (GPhP) және т. б. ) ;
ҚР МФ тәуелсіз мемлекеттің ұлттық фармакопеясы ретінде жайғастыру.

Республикада қолданыстағы фармакопея стандарттарын қолдану олардың басымдылығы қағидаты бойынша жүзеге асырылады. Бірінші басымдық деңгейі дәрілік заттар сапасының бас ұлттық стандарты ретінде ҚР МФ беріледі. Онда жекелеген монографиялар болмаған кезде немесе олар кеш өзектендірілген жағдайда ҚР МФ Үйлестірілген басқа фармакопеялардың тиісті монографиялары қолданылады (2-сурет) .
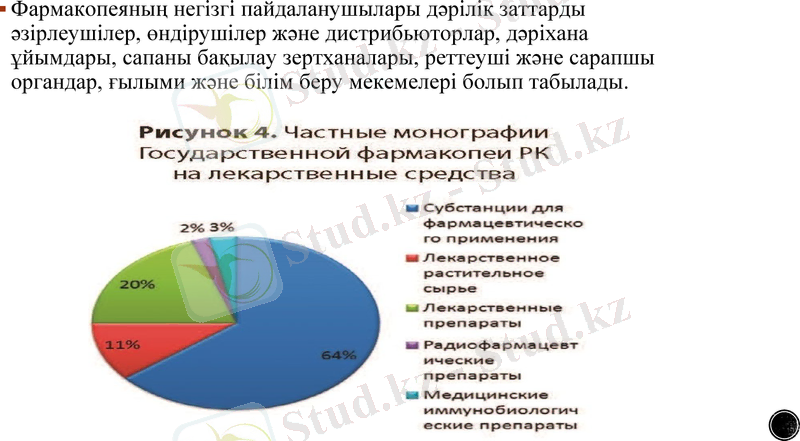
Фармакопеяның негізгі пайдаланушылары дәрілік заттарды әзірлеушілер, өндірушілер және дистрибьюторлар, дәріхана ұйымдары, сапаны бақылау зертханалары, реттеуші және сарапшы органдар, ғылыми және білім беру мекемелері болып табылады.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz