Химиялық кинетика және технологиялық режимдер: гомогенді және гетерогенді реакциялар, процестерге әсер ететін факторлар мен фазалық заңдылықтар



Химиялық кинетика. Гомогенді және гетерогенді реакциялар
Орындаған: Аушенова Аружан
Күзембаева Мейіргүл
Хаирова Мөлдір
Асфендияров атындағы Қазақ Ұлттық Медицина Университеті

Жоспар:
Химиялық-технологиялық үдерістердің кинетикасы
Гомогенді реакциялардағы процестердің өтуіне әсер ететін факторлар
Гетерогенді реакциялардағы процестердің өтуіне әсер ететін фазалар

Технологиялық режим деп ХТҮ-ті максималды эффективті жəне тұрақты жүргізуді қамтамасыз ететін параметрлердің жиынтығын айтады.
1850 жылы неміс химигі Л. Вильгельми (1812 - 1864) қамыс қанты инверсиясының,
1862 - 63 жылы француз химигі М. Бертло (1827 - 1907) этерификация реакциясы жылдамдықтарын зерттеп,
1882 - 90 жылы Ресей химигі Н. А. Меншуткин (1842 - 1907) заттың реакцияға бейімділігі мен құрылысының арасындағы тәуелділікті анықтады.
Нидерланд ғалымы Я. Вант-Гофф (1852 - 1911) және швед химигі С. Аррениус (1859 - 1927) қарапайым химиялық реакциялардың жүру заңдылықтарын ашты.
Технологиялық режимді таңдау кезінде химиялық кинетика заңдарын пайдалану
Химиялық кинетика заңдары
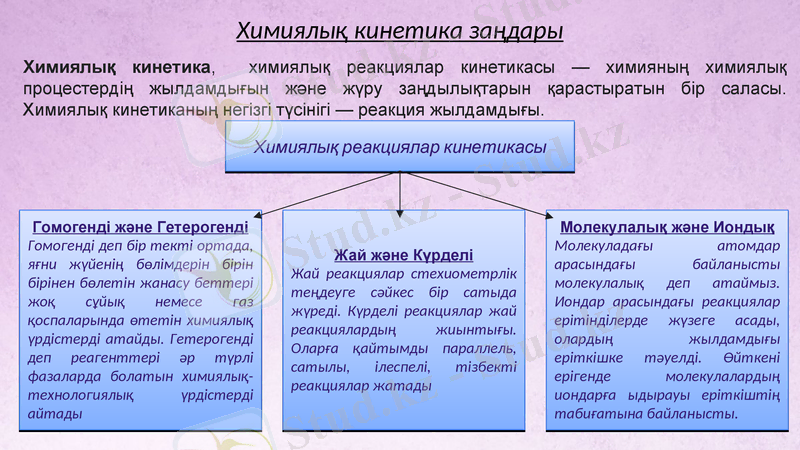
Химиялық кинетика, химиялық реакциялар кинетикасы - химияның химиялық процестердің жылдамдығын және жүру заңдылықтарын қарастыратын бір саласы. Химиялық кинетиканың негізгі түсінігі - реакция жылдамдығы.
Химиялық реакциялар кинетикасы
Гомогенді және Гетерогенді
Гомогенді деп бір текті ортада, яғни жүйенің бөлімдерін бірін бірінен бөлетін жанасу беттері жоқ сұйық немесе газ қоспаларында өтетін химиялық үрдістерді атайды. Гетерогенді деп реагенттері әр түрлі фазаларда болатын химиялық-технологиялық үрдістерді айтады
Жай және Күрделі
Жай реакциялар стехиометрлік теңдеуге сәйкес бір сатыда жүреді. Күрделі реакциялар жай реакциялардың жиынтығы. Оларға қайтымды параллель, сатылы, ілеспелі, тізбекті реакциялар жатады
Молекулалық және Иондық
Молекуладағы атомдар арасындағы байланысты молекулалық деп атаймыз. Иондар арасындағы реакциялар ерітінділерде жүзеге асады, олардың жылдамдығы еріткішке тәуелді. Өйткені ерігенде молекулалардың иондарға ыдырауы еріткіштің табиғатына байланысты.

Химиялық реакция жылдамдығына әр түрлі факторлар әсер етуі мүмкін. Біртекті жүйелерде мұндай факторлар температура, қысым және гетерогенді жүйелердегі құрам болып табылады, мәселе күрделене түседі.
Гомогенді реакцияның жылдамдығы - көлем бірлігіне уақыт бірлігіндегі зат мөлшерінің өзгеруі және уақыт бірлігіндегі заттардың біреуінің концентрациясының өзгеруі

1) әрекеттесуші заттардың концентрациясы;
2) температура;
3) катализатор;
4) ингибитор.
Гомогенді реакциялардағы процестердің өтуіне әсер ететін факторлар

Температураның жоғарылауымен көптеген. химиялық реакциялардың жылдамдығы артады. Бұл тәуелділікті Вант -Гофф ережесі сипаттайды: «Температураның әр 10 ° С жоғарылауымен химиялық реакциялардың жылдамдығы 2 - 4 есе артады».
Катализатор - бұл реакция жылдамдығын тездететін, өзі тұтынылмайтын зат.
Ингибитор - реакция жылдамдығын бәсеңдететін зат.
Келесі фактор - бетінің ауданы. Реактивті заттың беті неғұрлым үлкен болса, соғұрлым үлкен жылдамдыққа ие болады.

Гетерогенді реакциялардағы процестердің фазалары
Гетерогенді системалар екі немесе одан көбірек фазалардан тұрады. Фаза деп бірдей немесе бір нүктеден екінші нүктеге қарай өткенде термодинамикалық қасиеттер үздіксіз өзгеріп тұратын жүйенің материалдық бөліктерінің жиынтығын айтады.

Генри заңы. Сұйыктың берілген бір көлемінде тұрақты температуралық жағдайда еріген газдың массасы газдың парциальдық қысымына тура пропорционал болады:
С = кр
мұндағы С - қаныққан ерітіндідегі газдың массалық концентрациясы;
р - парциальдық қысым;
к - пропорционалдық коэффициент - Генри константасы.


е = к +п - ф
е- еркіндік дәрежесінің саны (немесе жүйенің варианттылығы) ;
к - жүйедегі тәуелсіз компоненттердің саны;
п - фазалар тепе-теңдігіне әсер етуші сыртқы параметрлер саны;
ф - фазалар саны
Фазалар ережесі еркіндік дәрежесін есептеуге мүмкіншілік береді, яғни осының арқасында екі немесе көп фазалы системалардағы фазалардың санын сол күйінде қалдырып, бір-біріне қатысынсыз өзгертуге болатын факторлардың (t, р, С{, С2) сан шамасын есептеп шығаруға болады.

Назарларыңызға рахмет!!!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz