Стехиометрия: тарихы, негізгі заңдары және есептеу тәсілдері



Стехиометрия. Стехиометрияның негізін қалаушы
Орындаған: Валерианова Толқын
Қабылдаған: Утемисова. А

Сабақтың мақсаты
Стехиометрия ұғымын тереңірек білу. Стехиометрияның негізін салушы
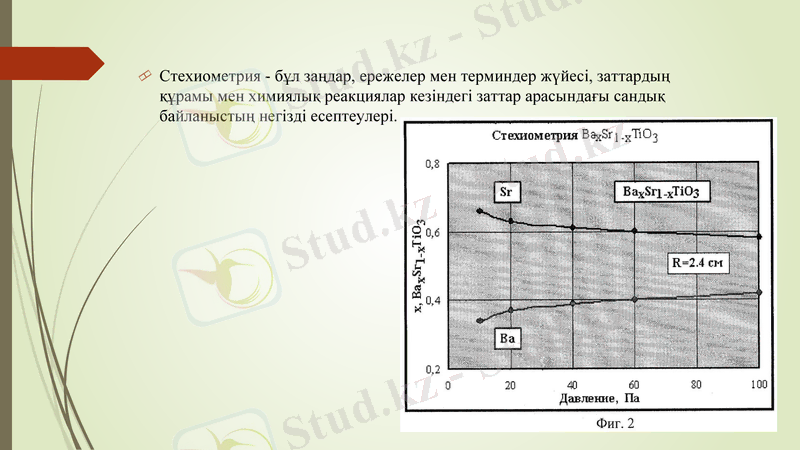
Стехиометрия - бұл заңдар, ережелер мен терминдер жүйесі, заттардың құрамы мен химиялық реакциялар кезіндегі заттар арасындағы сандық байланыстың негізді есептеулері.

Стехиометрияның негізін қалаушы - Еремия Бенджамин Рихтер (1762 ж. 1807), Хиршбергте (Силезия) туып, Кенигсбергте оқыды. 1793 жылы ол «Стехиометрияның басталуы, немесе химиялық элементтерді өлшеу әдісі », онда ол осыны көрсетті: элементтер белгілі бір қатынаста әрекет етеді. Рихтердің анықтамасы бойынша стехиометрия - өлшеу өнеріхимиялық элементтер. Терминнің бірінші бөлігі сөзбен бәріне таныс«Элемент». Мұнда ол элемент мағынасында қолданылады. Екінші бөлігі, ғылыми терминдерде жиі қолданылады, келеді«өлшеу» сөздері. Рихтер сандық қатынастарды химияда қолдануға болмайды деп мәлімдеген әйгілі философ И. Кантпен дәлелді түрде дауласты.

XIX ғасырдың басында-ақ затты зерттеуде сандық тәсілдердің керемет жетістіктері химиялық революцияны мүмкін етіп жалпы жаратылыстанумен атап айтқанда, химиядағы жаңа түпкілікті өзгерістерді әкелді. Лавуазье ашқан зат массасының сақталу заңынан кейін жаңа сандық заңдылықтардың тұтас топтары - стехиометриялық заңдар жалғасты.

Рихтер ашқан заң көптеген химиктердің химиялық қосылыстар кез-келген қатынаста емес, қатаң белгіленген сандық қатынастарда әрекеттеседі деген сенімдерін растады. Алайда, осыдан кейін, барлық химиялық құбылыстарға осындай анықтама қатысты ма деген пікірталас туды. Пікірталастың өзекті мәселесі екі немесе одан да көп элементтен тұратын қосылыстағы элементтердің арақатынасы тұрақты ма?, әлде заттың құрамы оны алу тәсіліне тәуелді ме? - деген сұрақтар болды. 1803 жылы Клод Луи Бертолле тартылу күштері мен заттың тығыздығы мен мөлшеріне тәуелді - химиялық жақындық теориясын ұсынып, заттың элементтік құрамы оның алыну жағдайларына байланысты өзгере алады деген пікірін сақтады (таңдамалы жақындық терминін 1770 жылы заттардың реакциялық қабілетін түсіндіру үшін Торнберг Улаф Бергман енгізген) .

Француз химигі Жозеф Луи Пруст қарама-қайшы көзқараста болуды ұйғарды. 1799-1806 жылдары терең зерттелген сараптамалар көмегімен қосылыс құрамындағы элементтер андарының қатынасы әрқашан тұрақты екендігін анықтады. Бертолленың тұжырымдары сараптамалардың дәл еместігімен, қолданған заттардың жеткілікті түрде таза болмауынан деп көрсетті Пруст. 1801 жыл мен 1808 жылдар аралығында жалғасқан екі ғалымның пікірталасы, Прусттың керемет жеңісімен аяқталды. Құрам тұрақтылық заңы (тұрақты қатынастардың) көптеген химиктер арасында қабылданып қана қоймай, химиялық заңдардың негізгілерінің бірі болды. Сонымен қатар, қосылыс құрамының тұрақтылығының себебі ашық қалды. Туындаған күмәнді тек материяның дискреттігі туралы болжам шешуі мүмкін, алайда, атомистикалық көзқарастар әлі де тікелей тәжірибелік түрде дәлелденген жоқ еді.
Стехиометрияның негізі - заттың атомдық және молекулалық құрылымы, химиялық реакциялар кезінде атомдардың сақталуы және атомдардың валенттілігі, ол өзгеруі мүмкін болса да, әрқашан аз ғана бүтін сандармен өрнектеледі. Химия негіздерін үйрету кезінде заттардың құрамын формулалармен есептеу, химиялық реакциялардың теңдеулерін құру, оларды есептеу маңызды сандық міндеттер болып табылады. Бұл тапсырмаларда стехиометрия қолданылады.

Реакция теңдеулерін құруда қарапайым дағдылар болған кезде, есептеулерде әлі де кейбір қателіктер жібереді. Олардың бірі ереже бұзылған кезде туындайды: бір -бірінен тәуелсіз жүретін реакциялардың теңдеулерін қосуға немесе мұндай реакциялардың толық теңдеулерін тікелей жазуға болмайды. Калий хлорид калий оксалат пен калий фторид қоспасына қосылды делік. Кальций хлориді жеткілікті болған кезде екі химиялық реакция жүреді

Бұл реакциялардың қосылуы тұздардың қосылысына әсер береді, калий мұнда зат мөлшерінің қатынасына 1: 2 қатынасында әсер етеді:
Шын мәнінде, калий тұздарының бастапқы қоспасы ерікті құрамға ие болуы мүмкін, сәйкесінше тұнбадағы тұздардың қатынасы өзгеруі мүмкін.

Егер қосалқы заттар толық теңдеуде болмаса, дербес жүретін екі реакцияның қосылу фактісі байқалмауы мүмкін. Мысалы, сутегі асқын тотығы калий перманганатының әсерінен тотығады, сонымен бірге суға және оттекке ыдырауы мүмкін.
Реакцияларды қосу теңдеуді береді

Тәуелсіз реакциялардан айырмашылығы, қосу тұрақты реакцияларға рұқсат етіледі және үнемі қолданылады, өйткені әдетте көп сатылы реакциялардың теңдеулерін жазу қажет. Дегенмен, егер бірізді реакциялар қайтымды болса, онда жиынтық теңдеулерді жазу жиі қажет емес, себебі бұл реакция өнімдері туралы қате қорытындыларға әкеледі. Мысалы, фосфор қышқылының диссоциациясы кезінде дигидроген фосфат ионы H2PO4¯ ең көп мөлшерде - диссоциацияның бірінші сатысында түзіледі:
Бірақ толық диссоциациялану реакциясында

Стехиометрияның онша танымал емес ережелеріне көшейік. Стехиометрияның ең күтпеген, бірақ қатаң дәлелденген мәлімдемесі - реактивтер теріс стехиометриялық коэффициенттерге ие. Химиялық реакцияны жазу керек екені белгілі болды, мысалы:

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz