Химиялық процестер мен реакциялардың кинетикасы: түрлері, заңдылықтары және жылдамдыққа әсер ететін факторлар



Химиялық процестердің кенетикасы
Орындаған: Иса Айбала 1-курс магистр
Қабылдаған: Керимбаева К. З.

Жоспар
Химиялық процестің түрлері
Химиялық кинетика
химиялық реакциялардың жүру заңдылықтары
Химиялық реакцияның жылдамдығына әсер ететін факторлар.

Химиялық процесс дегеніміз -бұл химиялық реакциялар. Химиялық реакциялар заттардың өзара әрекеттесуі нәтижесінде олардың химиялық құрамы мен құрылысы өзгеріп, басқа заттарға айналуы. Химиялық реакциялар масса сақталу заңы мен эквивалент заңына негізделген. Химиялық реакциялардың ядролық реакциялардан айырмашылығы реакция кезінде әрекеттесетін затрат құрамындағы химиялық элементтер мен олардың атомдарының жалпы санының өзгермейтіндігінде. Химиялық реакциялар химиялық теңдеулер арқылы өрнектеледі. Химиялық процесссе тура реакция мен қатар бастапқы заттар қайта түзілетін кері реакция жүреді. Қайтымды реакцияда тура реакция мен кері реакцияның жылдамдықтары теңескенде жүйеде химиялық тепе-теңдік орнайды, бірақ кері процессс баяу жүретіндіктен көптеген химиялық реакциялар қайтымсыз, яғни аяғына дейін жүреді.
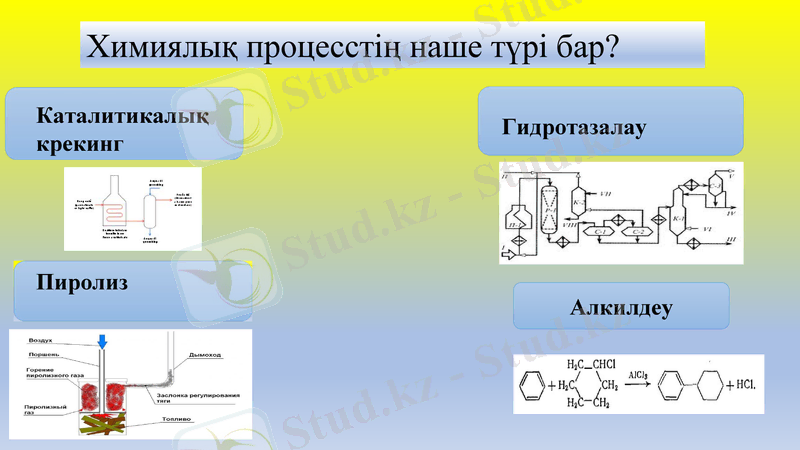
Химиялық процесстің наше түрі бар?
Каталитикалық крекинг
Пиролиз
Гидротазалау
Алкилдеу

Каталитикалық крекинг 450 - 5000 С температурада, атмосфералық қысымда, катализатор қатысындажүргiзiледi. Катализатор ретiнде-алюмосиликаттар қолданылады. Катализатор - қатты, кеуектiдене, негiзгi құрамы AІ2O3-тен тұрады. Осы катализаторды қолданғанда бензин шығымы-70%, газ шығымы-12-15%. Осы әдiспен алынған бензиннiң октан саны 78-82 дейiн барады және сақтау барысында қасиетiн өзгертпейдi.
Висбкркинг ( немесе жайлап крекингілеу) дегеніміз - қалдықтар гудрон және жартылай гудроннан бастапқы шикізатқа қарағанда тұтқырлығы және суу температурасы төмен қазандық отындарын алуға арналған термиялық крекинг процесінің бір формасы.

Пиролиз (гр. pyr - от, гр. lysis - еріту, ажырату) - қатты қалдықтарды, бірінші кезекте тұрмыстық қоқысқалдықтарды 400°С-тан 700°С-қа дейінгі температурада ауасыз термиялық ыдырату жолымен өңдеу әдісі. Пиролиз кезінде энергия көзі ретінде пайдалануға болатын жанғыш газ - швельгаз бөлінеді (құрамында едәуір мөлшерде метан бар) . Қоқыстарды қоқыс жағатын заводтарда жағумен салыстырғанда Пиролиз тұрмыстық қалдықтарды толығымен өңдеуге мүмкіндік береді. Бұл жағдайда атмосфераға қауіпті заттектер аз шығарылады және олардың күлде аз ғана мөлшері қалады
Гидротазалау- мұнай өнімдерін тазалау мақсатында оған 250 - 420°С температура мен 2 - 5 МПа қысымда катализатор арқылы сутекпен әсер ету процесі. Оның нәтижесінде мұнай өнімдеріндегі қоспалар гидрогенолизге ұшырап, көмірсутектер мен оңай ұшатын заттар (NH3, H2O, H2S) тұз.
Табиғи және іліспе мұнай (яғни мұнай төтел) көмірсутек газдары отын және мұнай химиясының шикі затын өндіруде өте құнды шикі заттарға жатады. Бұл газдарды алғашқы өңдеудің негізгі өнімдері - газ бензині, сұйытылған және құрғақ газдар, техникалық жеке көмірсутектері: пропан, н-бутан, изобутан, пентан.

Алкилдеу дегеніміз алкил тобин органикалық заттың көміртек-оттек байланыстары арқылы енгізу реакция ларын айтады. Сонымен қатар синтезін этерификация реакция ларына да жатқызуға болады, этерификация спирттерден және органикалық қышқылдардан дай немесе күрделі эфирлердің түзілу реакция лары.

Химиялық кинетика
Химиялық кинетика, химиялық реакциялар кинетикасы - химияның химиялық процестердің жылдамдығын және жүру заңдылықтарын қарастыратын бір саласы.

Химиялық реакциялардың жүру заңдылықтарымен танысу үшін мынадай түсініктерге және заңдарға анықтама берейік:
фаза
гомогенді және гетерогенді жүйелер мен реакциялар
химиялық реакциялардың жылдамдығы
әрекеттесуші массалар заңы
Вант-Гофф ережесі
катализ
катализатор


Гомогенді
Химиялық реакциялар
Гетерогенді
Гомогенді жүйелерде әрекеттесетін заттардың агрегаттық күйі бірдей немесе бір фазаның көлемінде жүретін реакцияларды гомогенді реакциялар деп атайды.
Гетерогенді жүйелер бірнеше фазадан тұрады; әрекеттесуші заттар әр түрлі агрегаттық күйде болатын реакцияларды гетерогенді реакциялар деп атайды
Фаза - гетерогенді (әртүрлі) жүйенің біртекті бөлігі. Мысалы, О˚С су үш агрегаттық күйде болып: мұз, су мен бу - үш фазадан тұратын гетерогенді жүйе түзеді: қатты фаза - мұз, сұйық - су және газтекті фаза - бу

Химиялық реакцияның жылдамдығы
Химиялық реакцияның жылдамдығы уақыт өлшемінде әрекеттесетін заттардың немесе түзілген өнімдерінің біреуінің зат мөлшері жүйенің белгілі бір көлемінде (гомогенді реакция) немесе фаза бетінің аудан бірлігінде (гетерогенді реакция) өзгеруін айтады.
Гомогенді реакция жүйенің бүкіл көлемінде жүреді:
Гетерогенді жүйелерде реакция фазааралық бетте жүреді:

Әрекеттесуші массалар заңы
Әрекеттесуші массалар заңы: химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz