Ерітінділер және электролиттік процестер: теориясы, қасиеттері және қолданылуы



Ерітінділер және электролиттік процесстер

Жоспар:
Ерітінділер және оның концентрациялары.
Еру механизмі.
Сұйықтардың және газдардың ерігіштігі.
Рауль заңдары.
Қатты заттардың ерігіштігі.
Осмос және диффузия.
Электролиттердің қасиеттері ЭДТ.

Табиғи ерітінділер.
Минералданған су
Жануарлардың қаны.
Мұхит суы

Ерітінділердің өмірде қолданылуы
Тамақ өнімдері
Дәрілік препараттар.
Минералданған асханалық ауыз сулар
Өнеркәсіпте шикізат
Ерітінділердің биологиялық маңызы
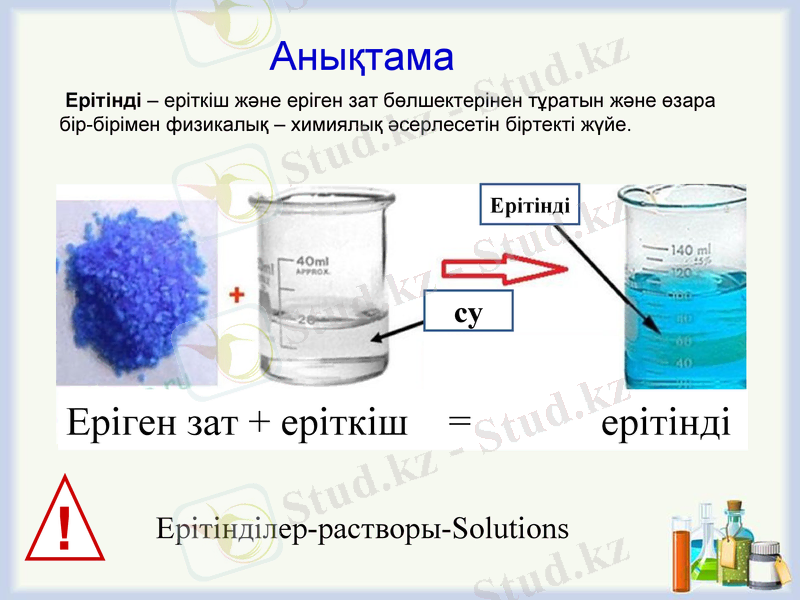
Анықтама
Ерітінді - еріткіш және еріген зат бөлшектерінен тұратын және өзара бір-бірімен физикалық - химиялық әсерлесетін біртекті жүйе.
Ерітінділер-растворы-Solutions
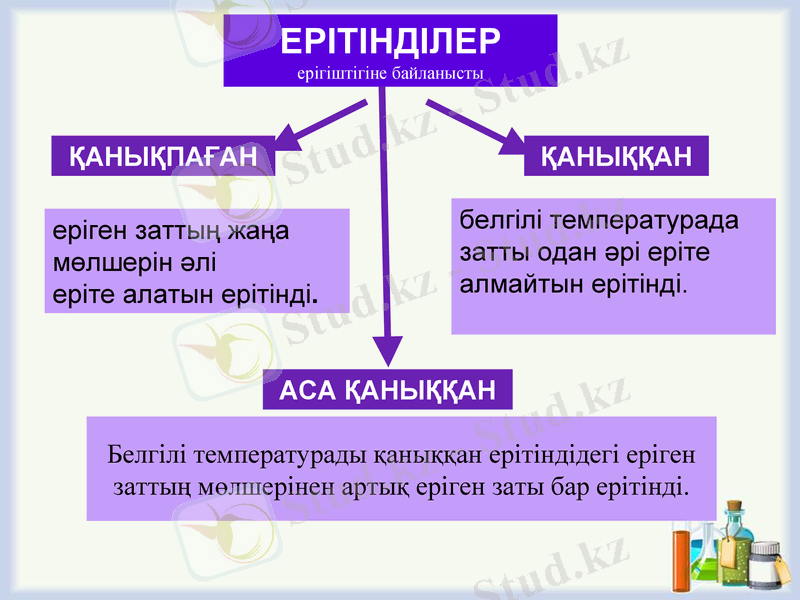
ЕРІТІНДІЛЕР
ерігіштігіне байланысты
ҚАНЫҚПАҒАН
ҚАНЫҚҚАН
еріген заттың жаңа мөлшерін әлі
еріте алатын ерітінді.
белгілі температурада затты одан әрі еріте алмайтын ерітінді.
АСА ҚАНЫҚҚАН
Белгілі температурады қаныққан ерітіндідегі еріген заттың мөлшерінен артық еріген заты бар ерітінді.

ЕРІТІНДІЛЕР
СҰЙЫТЫЛҒАН
КОНЦЕНТРЛІ
еріген заттың мөлшері аз болса
Еритін зат мөлшері көп болса

Концентрация-концентрация-concentration

Ерітінді концентрациясының түрлері
Еріген заттың массалық үлесі - [w%] ерітіндінің 100 масса бөлгенде еріген зат массасының бөлігі.
Еріген зат-растворенное вещество-permeate

Ерітіндінің мольдік концентрациясы- 1 л ерітіндідегі еріген зат мольінің саны
Ерітінді концентрациясының түрлері
См -мольдік концентрация, моль/л
М - еріген заттың молярлық массасы, г, кг
V-ерітіндінің көлемі, л

Ерітіндінің нормальды концентрациясы - Сн 1 л ерітіндіде еріген заттың эквивалентінің массасы
Ерітінді концентрациясының түрлері
Сн -мольдік концентрация, моль/л
V-ерітіндінің көлемі, л
Э - еріген заттың эквивалент саны, г/моль

Выражение концентраций растворов.
Моляльная концентрация (моляльность) - число молей растворенного вещества на 1000 г растворителя.

Еру - физико-химиялық процесс

Физикалық процесс
Кристалл торлар бұзылып, еріген зат бөлшектері
еріткіш молекулалары арасында таралады
Физикалық процесс
энергия сіңірумен
сипатталады.

Химиялық процесс
Еріген зат пен еріткіштің молекулалары әрекеттеседі.
Химиялық процесс
энергия бөлінуімен сипатталады.

Еру үрдісі кезінде
Жылу сіңіріледі (NaCl, KCl, NH4Cl)
немесе жылу бөлінеді (H2SO4, NaOH, KOH) .
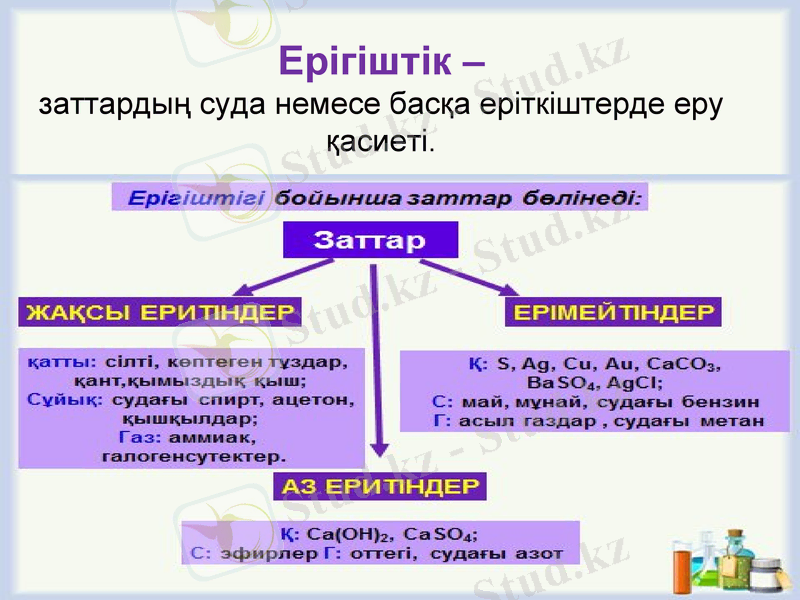
Ерігіштік -
заттардың суда немесе басқа еріткіштерде еру қасиеті.

Ерігіштікке әртүрлі факторлардың әсері

ЖАҚСЫ
ЕРИТІНДЕР

ЕРІМЕЙТІНДЕР

МҮЛДЕ
ЕРІМЕЙТІН
ЗАТТАР
ЖОҚ


Ерігіштік көптеген қатты заттар t көтерілгенде
артады, ал газтәрізді заттар үшін төмендейді.
Қатты зат
твердая вещь
hard thing

Газтәрізді заттарда ерігіштік
қысым артқанда артады.
Газ-газ-Gas

Ерітіндінің қасиеттері
Газдарға диффузия тән болса, электролит емес ерітінділерге де диффузия тән. Еріген зат молекулаларының бүкіл ерітінді бойына өз бетімен ретсіз таралу құбылысын диффузия деп атайды.
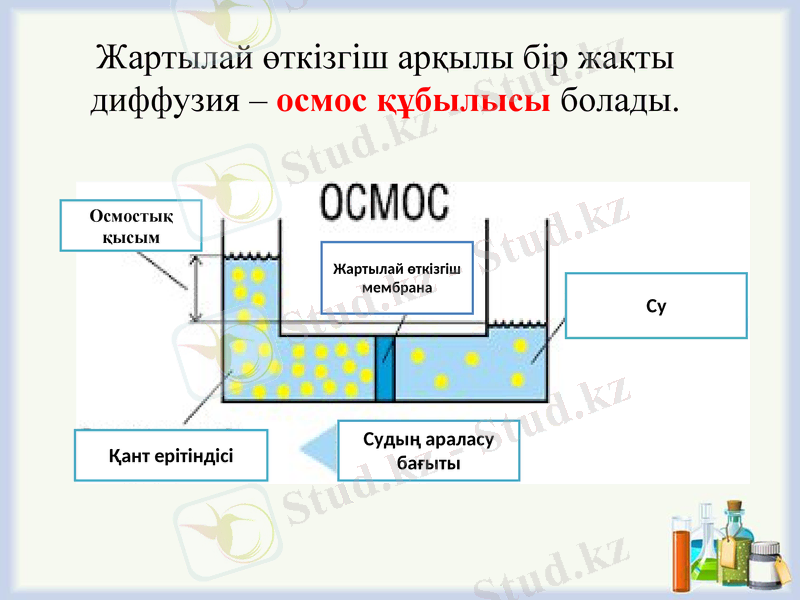
Жартылай өткізгіш арқылы бір жақты диффузия - осмос құбылысы болады.
Су

Жартылай өткізгіш арқылы еріткіштің ерітіндіге өтуге қабілетін көрсететін күш өлшемі ерітіндінің осмос қысымы деп аталады.
Ерітіндінің осмос қысымы, сол еріген зат газ күйінде
болып, осы температурада, ерітіндінің көлеміндей
көлем алып тұрғандағы туғызатын қысымына тең.
(Вант-Гофф заңы)
pосм=cRT
мұндағы с - ерітіндінің молярлы концентрациясы, моль/л;
R - константа, сандық мәні газдар тұрақтысына тең, 0, 082л-атом/град,
Т - абсолют температура.

Рауль заңдары

II заңы: Ерітінділердің қату температурасының төмендеуі және қайнау температурасының жоғарылауы заттың ерітінділерінің концентрациясына тура пропорционал.
Рауль заңдары
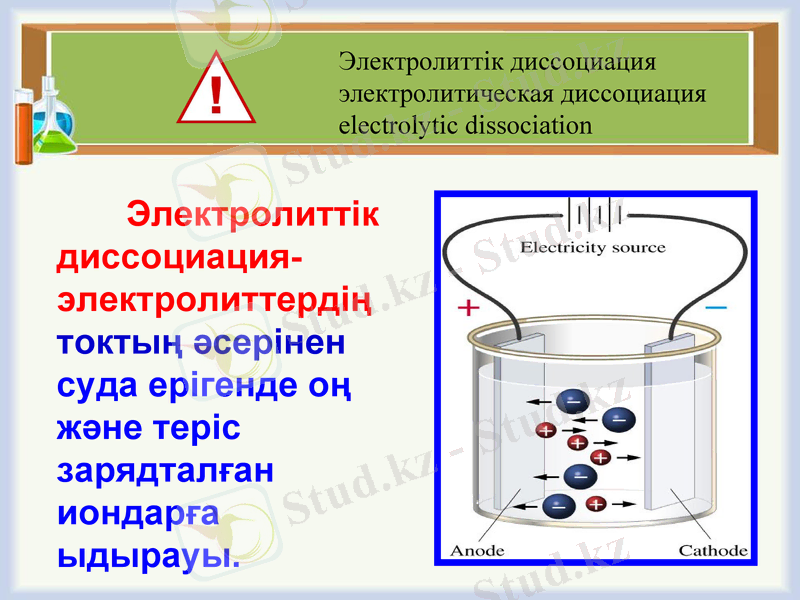
Электролиттік диссоциация-электролиттердің токтың әсерінен суда ерігенде оң және теріс зарядталған иондарға ыдырауы.
Электролиттік диссоциация
электролитическая диссоциация
electrolytic dissociation

Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар) .
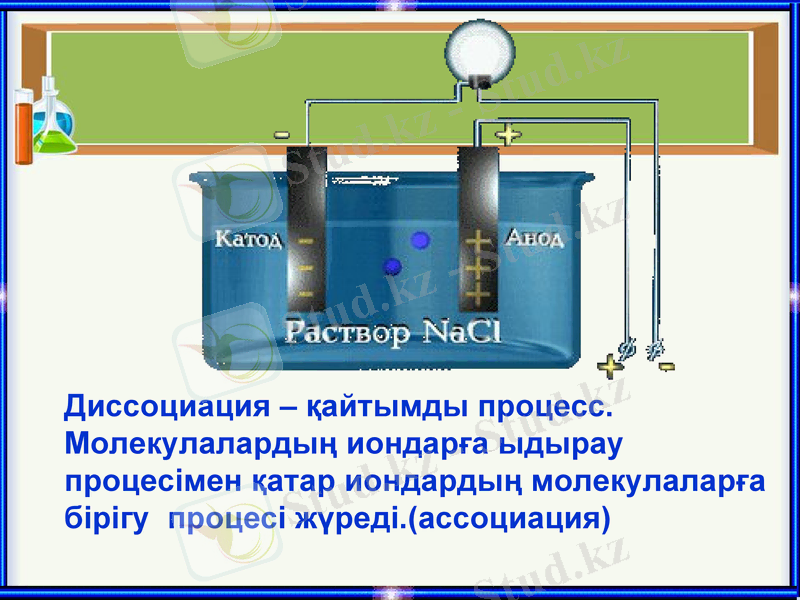
Диссоциация - қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулаларға бірігу процесі жүреді. (ассоциация)
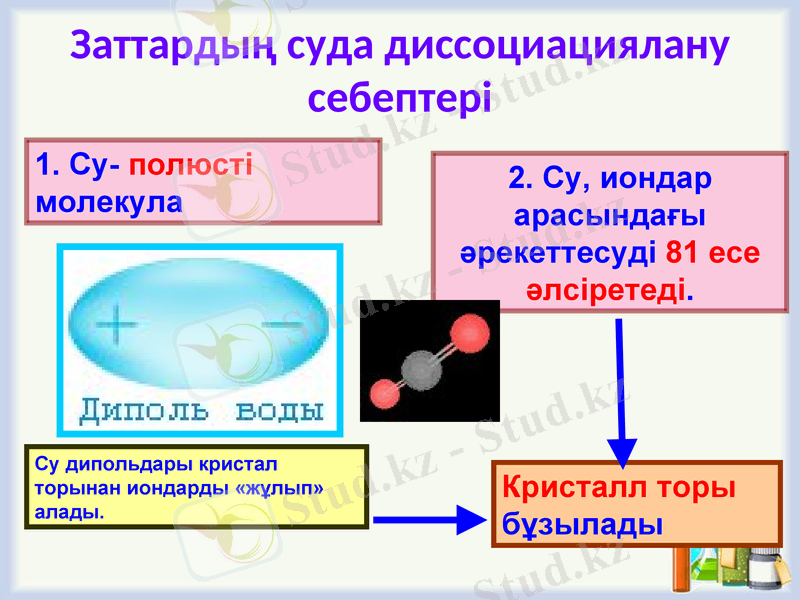
Заттардың суда диссоциациялану себептері
1. Су- полюсті молекула
2. Су, иондар арасындағы әрекеттесуді 81 есе әлсіретеді.
Кристалл торы бұзылады
Су дипольдары кристал торынан иондарды «жұлып» алады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz