GMP талаптары және дәріханаішілік бақылау жүйесі



Орындаған: Ергеш Н. Қ.
Тобы: ФӨТ 19-013-1К
Тексерген: Даулбаева А. Ө.
Алматы 2021 жыл.
СОӨЖ.

GMP стандарттарыңың негізі 1963 жылы АҚШ-та қаланды. Бұл ережелер 1992 жылға дейін бірнеше рет қайта өңдеуден өтіп, толықтырылып отырды. GMP стандарттарына халықаралық статусы 1968 жылы БДСҰ қатысында құрастылғаны үшін берілді. GMP ережелері бүкіл әлемде қолданылады. 2014 жылы барлық отандық фармацевтикалық өндіріс орындары GMP стандарттарына өтуі қажет. Қазіргі кезде GMP ДЗ өндірушілердің дамыған елдер нарығына шығуының шарты болып отыр.
Бұл стандарт өндірістің бастапқы заттарынан бастап, құрал-жабдықтар, ғимараттар және персоналдың жеке бас тазалығы сияқты барлық аспекттерін қамтиды.
Кіріспе

Бұл халықаралық сапа стандарттарына сәйкес фармацевтикалық өнімдер өндірісін үнемі қолдау және бақылауды қамтамасыз ету жүйесі болып табылады. Сонымен бірге, фармацевтикалық өнім сапасын шикізат пен материалдардан бастап дайын өнімді шығарғанға дейінгі, оның ішіне тасымалдау мен сақтауды да ескере отырып, бақылау да кіреді.
GMP негізгі мақсаты-өндірілген өнімнің сапасының жоғары екендігіне кепіл болу.
Соңғы өнімнің сапасына әсерін тигізетін әр үрдіс үшін арнайы нұсқаулар мен жүйелер, өндірістің әр кезеңінде орындалатын барлық тиісті рәсімдерді растайтын құжаттар жасалған. GMP стандарты фармацевтикалық өндірістің барлық кезеңдерінде сапасыз өнім алу тәуекелін азайтуға шақырады.
.
Тиісті өндірістік тәжірибе - GMP (Good Manufacturing Practice) .

GMP стандартына сай өндіріс орындарының құрылысы ең басты мақсат - өнімнің таза болуына бағынуы тиіс.
Мұндай өндіріс орындарында шаң-тозаң жиналатын жерлердің аз болуы қолға алынады, тазалығы бақыланып отыратын ауа жіберу қамтамасыз етіледі, жоғары қысым, белгілі температура мен ылғалдылық әрдайым бір қалыпта ұсталып отырады. Мұндай өндіріс орындары «таза» деп аталады.
Біздің елімізде «таза» өндіріс орындарында ауа қысымы айырмашылығы 4мм. сын. бағ., температура 23+20С, салыстырмалы ылғалдылығы 30-40%болуы қамтамасыз етіледі.

Қызметкерлерге қойылатын GMP талаптары
Өндіруші қарамағында қажетті біліктілігі мен практикалық тәжірибесі бар тиісті қызметкерлер болуы.
Өндірушіде әрбір қызметкер сәйкес жұмыс орнында белгілі міндеттерін орындайтын схема болуы тиіс.
Басшы қызметкерлер: өндіріс және бөлім жетекшілері, олар бір-біріне бағынбайтын уәкілетті тұлғалар.

Уәкілетті тұлғалардың міндеттері
1. дайындалған әрбір ДЗ сериясы НҚ және тіркеу досьесі талаптарына сәйкес жасалып, сыналған болуын растау
2. ДЗ әрбір импортталған сериясының Украинадан тыс жасалған, бірақ Украинадан толық сандық және сапалық талдаудан міндетті түрде өткендігін растау
3. Барлық операциялар жүргізіліп болған соң, реестрде немесе эквивалентті құжатта тіркелуі қажет, сонымен бірге босатуға рұқсат беру алдында ДЗ әр сериясының барлық нормаларға сай екендігін куәландыру
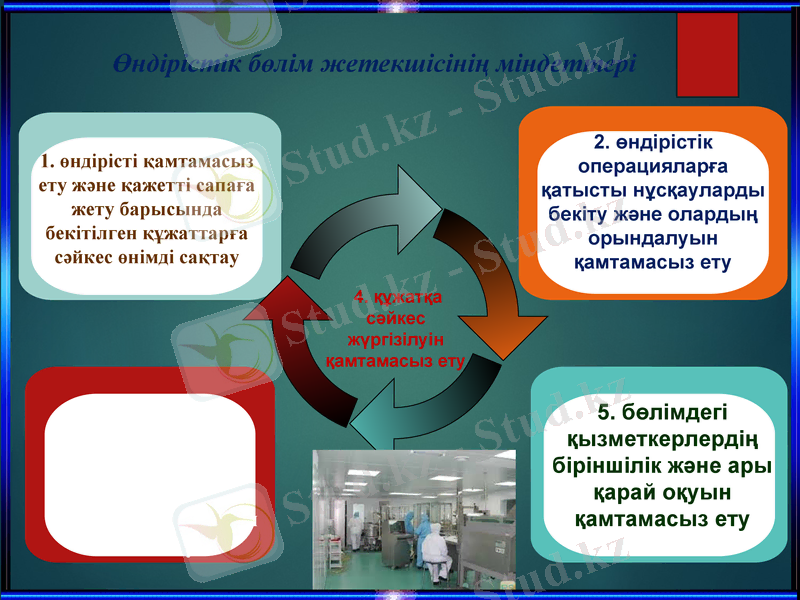
4. құжатқа сәйкес жүргізілуін қамтамасыз ету
3. өз бөлімінің жағдайын, қызмет көрсетуін және ғимараттар мен құрал-жабдықтарды бақылау
1. өндірісті қамтамасыз ету және қажетті сапаға жету барысында бекітілген құжаттарға сәйкес өнімді сақтау
5. бөлімдегі қызметкерлердің біріншілік және ары қарай оқуын қамтамасыз ету
2. өндірістік операцияларға қатысты нұсқауларды бекіту және олардың орындалуын қамтамасыз ету
Өндірістік бөлім жетекшісінің міндеттері

жұмысқа қабылданар алдында медициналық тексеруден өтуі тиіс
жұқпалы аурулармен немесе ашық жаралармен өндіріске кіруге тиым салынады
орындалатын жұмыс түріне байланысты қорғаныш киімін кию қажет
өндіріс аймағында тамақтануға, сусын ішуге жіне тағам, сусындар, табак өнімдерін сақтауға тиым салынады
ашық өнім мен оператор қолының тікелей жанасуынан абай болған жөн.
Ғимараттар мен қондырғыларға қойылатын талаптар
1. ғимараттар мен қондырғылардың орналасуы, жобалануы, лайықты жабдықталуы, пайдаланылуы жүргізілетін операциялар түрлеріне байланысты талапқа жауап беруі тиіс;
2. олардың орналасуы мен конструкциясы өте аз тәуекелга әкелуі қажет;
3. қиыстырылған контаминацияны болдырмау мақсатында тиімді тазалау және қызмет көрсету мүмкіндігін қамтамасыз ету қажет.
Қызметкерге қойылатын талаптар

GМP термині ағылшын тілінен аударғанда, фармацевтикалық индустрияға қатысты реттеуші актілер топтарын «Good . . . Practice» анықтайды. GMP стандартының идеологиясы «сапа дәрілік өнімге сынау жолымен енгізілмеуі тиіс: ол өндіріс үрдісінде өздігінен жасалынуы қажет» ұғымын бекітуге негізделген. GMP стандарттар жиынтығының негізгі идеясы барлық бизнес-үрдістер тізбегінің мөлдір жүйесін және өндірушіден пациентке жеткенге дейінгі дәрілік заттардың жүру кезеңдерін құру болып табылады. Сондықтан аталған жүйе дәрілік заттардың барлық кезеңдерінде оның сапасын, қауіпсіздігін, эффективтілігін қамтамасыз ететін талаптарға жауап беруі және нарықта бәсекелестік артықшылыққа жетуде шығын/пайда критерийіне сәйкес болуы тиіс.
GМP серияларында тауар сапасын жасалғаннан бастап сатылғанға дейін басқару талаптары жинақталған:
Good Manufacturing Practice (GMP) - «Тиісті өндірістік іс-тәжірибе»;
Good Engineering Practice (GEP) - «Тиісті инженерлік іс-тәжірибе»;
Good Laboratory Practice (GLP) - «Тиісті зертханалық іс-тәжірибе»;
Good Clinical Practice (GCP) - «Тиісті клиникалық іс-тәжірибе»;
Good Storage Practice (GSP) - «Тиісті қоймалық іс-тәжірибе»;
Good Distribution Practice (GDP) - « Тиісті дистрибьюторлық іс-тәжірибе »;
Good Pharmacy Practice (GPP), «Тиісті дәріханалық іс-тәжірибе».
Дәрілік заттар айналымы саласында келесі стандарттар жұмыс жасайды:
Sterility Assurance Level (SAL), «Стерильдікті кепілдеу деңгейі »;
Quality Assurance Plan (QAP), «Сапаны қаматамасыз ету жоспары »;
Quality Managment System (QMS), «Сапаны басқару жүйесі »;
Quality Policy Documents (QPD), «Сапа саясаты »;
Hazard Analysis of Critical Control Points (HACCP), «Қиын бақылау нүктелеріндегі тәуекелдік талдау жүйесі ».
Қорытынды:
Қорытынды

Пайдаланылған әдебиеттер
1. Арыстанова Т. А. Общая фармацевтическая химия/Учебное пособие. - Шымкент. -2008. -157 б.
2. Арзамасцев А. П. . Фармацевтическая химия: учебное пособие, 3-е изд., испр. -М. :ГЭОТАР-Медиа. -2006. -640 б.
3. Анализ лекарственных смесей / Арзамасцев А. П., Печенников В. М., Родионова Г. М. и др. -М. : Компания Спутник +. -2000. -275 б.
4. Беликов В. Г. Фармацевтическая химия. В 2-х ч: учебное пособие, 4-е изд., перераб. и доп. -М. : МЕДпресс-информ. -2007. -624 б.
5. Қазақстан Республикасының Мемлекеттік фармакопеясы. -Алматы: «Жібек жолы» баспа үйі. -2008. -1 Т. -592 б.

Орындаған: Ергеш Н. Қ.
Тобы: ФӨТ 19-013-1К
Тексерген: Даулбаева А. Ө.
Алматы 2021 жыл.
СӨЖ.

Жоспары:
Дайындалған дәрілік препараттарға дәріханаішілік бақылау жүргізу
Алдын ала (ескерту) іс-шаралар;
Дәрілік препараттарды дайындау үшін пайдаланылатын бастапқы материалдарды (дәрілік субстанция, қосалқы зат) қабылдау кезінде бақылау;
Жазбаша бақылау;
Іріктелген сауал алу бақылауы;
Органолептикалық бақылау;
Іріктелген физикалық бақылау;
Химиялық бақылау;
Босату кезіндегі бақылау
Қорытынды
Пайдаланылған әдебиеттер

Дайындалған дәрілік препараттарға дәріханаішілік бақылау жүргізу қағидаларын бекіту туралы Қазақстан Республикасы Денсаулық сақтау және әлеуметтік даму министрінің 2015 жылғы 28 мамырдағы № 405 бұйрығымен бекітілген.

Дәрілік препарат мына көрсеткіштерге сәйкес келмеген жағдайда қанағаттанарлықсыз деп танылады:
1) сипаттамасы (сыртқы түрі, түсі, иісі) ;
2) мөлдірлігі және түсі;
3) ыдырауы;
4) біртектілігі (ұнтақтардың, жақпамайлардың, суппозиторийлердің, гомеопатиялық тритурациялардың ұсақтталуы немесе араласуы бойынша) ;
5) сұйық дәрілік препараттарда көзге көрінетін механикалық қоспалардың болмауы;
6) түпнұсқалығы;

7) көлемі немесе салмағы бойынша жазылуынан, жалпы салмағы (көлемі) бойынша, жекелеген дозалардың жалпы салмағы мен олардың мөлшері бойынша, жекелеген дәрілік заттардың жазылған дозаларының салмағы бойынша (немесе концентрациясы бойынша) ауытқулары;
8) қышқылды-сілтілі теңгерім шамасы;
9) тығыздығы;
10) стерильдігі;
11) микробиологиялық тазалығы;
12) тығынының тұмшалануы (стерильді дәрілік препараттар үшін) ;
13) босатуға арналған дәрілік препараттың ресімделуі.
Қанағаттандырмайды (жарамсыз) деп танылған дайындалған дәрілік препараттар алынуға және жойылуға тиіс.

Алдын ала (ескерту) іс-шаралары:
1) Дәрілік препараттардың асептикалық жағдайда дайындау шарттарын сақтау;
2) таразы-өлшеу аспаптарының жарамдылығы мен дәлдігін қамтамасыз ету, оларға жыл сайын тексеру жүргізуден;
3) тазартылған суды, инъекцияларға арналған суды алу, жинау, сақтау үшін тиісті жағдайларды, биркасында: алынған күнін, талдау нөмірі мен талдау жүргізген адамның қолын көрсету түріндегі ыдысты таңбалаудың дұрыстығын қамтамасыз етуден;
4) реактивтерді, эталондық және титрленген ерітінділерді сақтау мерзімін, шарттарын сақтау және оларды дұрыс ресімдеуден (заттаңбасында атауынан басқа: концентрациясы, молярлығы, алынған күні, жарамдылық мерзімінің аяқталатын күні, сақтау шарттары, кім дайындағаны көрсетіледі) ;
5) тексерілетін дәрілік препараттардағы ауытқуларды оларды дәріханаларда дайындау кезінде пайдаланылатын сол типті өлшеу құралдарын қолдану арқылы (бірдей метрологиялық сипаттамасы бар) анықтаудан;
6) бюреттік қондырғылар мен штангластарды тиісінше өңдеу, толтыру, рәсімдеуден тұрады.

Дәрілік препараттарды дайындау үшін пайдаланылатын бастапқы материалдарды (дәрілік субстанция, қосалқы зат) қабылдау кезіндегі бақылауды жүргізу
Дәрілік заттарды дайындауға пайдаланылатын бастапқы материалдарды (дәрілік субстанция, қосалқы зат) қабылдауды бақылау өнім партиясын сипаттайтын құжаттарды (тауарлық жүкқұжат, өндіруші зауыттың сапа сертификаты), ілеспе құжаттарда көрсетілген сериялармен дәрілік субстанция және қосалқы материалдардың үлгілеріндегі серияның сәйкестігін, сондай-ақ "Қаптама", "Таңбалау" және "Сипаттама" көрсеткіштері бойынша дәрілік субстанцияларды және қосалқы материалдарды сәйкестендіруді тексеруден тұрады".
"Қаптама" көрсеткіші бойынша дәрілік субстанциялар мен қосалқы заттардың тұтастығы мен физикалық-химиялық қасиеттеріне сәйкестігі тексеріледі;
"Таңбалау" көрсеткіші бойынша заттаңбасында өндірушінің соңғы өлшеп-салуды жасаған кәсіпорынның атауы, дәрілік субстанцияның, қосалқы заттың атауы, оның салмағы (көлемі) көрсетіліп, олардың саны, салмақ немесе көлемінің бірлігіне құрамы, сериялық нөмірі, жарамдылық мерзімі, өлшеп-орау күні көрсетіліп, тексеріледі.
"Сипаттама" көрсеткіші бойынша сыртқы түрі, түсі, иісі, біртектілігі, ерітінділердегі көрінетін механикалық қоспалардың болмауына тексеріледі.

Жазбаша бақылау:
Жазбаша бақылау дәрілік препарат дайындалғаннан кейін бірден ерікті нысандағы бақылау парағын толтыруды білдіреді.
Бақылау парағында:
1) дайындалған күні;
2) рецептінің нөмірі немесе бөлімше атауы көрсетілген медициналық ұйым талабы;
3) алынған дәрілік заттардың атаулары, олардың саны, жалпы көлемі немесе салмағы, доза саны;
4) дәрілік препаратты дайындаушының, өлшеп салушының және тексерушінің қолдары көрсетіледі.
Бақылау парағында есірткі құралдардың, улы, психотроптық заттардың, прекурсорлар атауы қызыл қарындашпен сызылады, балаларға арналған дәрілік препараттарға - "Б" әрпі қойылады.
Бақылау парағы дайындау технологиясының тәртібіне сәйкес латын тілінде толтырылады. Гомеопатиялық дәрілік препараттарға бақылау парағын толтыру кезінде реттілікпен алынған гомеопатиялық ингредиенттердің атаулары көрсетіледі.

Ішінара сауал жүргізуді бақылау
Іріктеп сауал жүргізу бақылауы фармацевт кемінде бес дәрілік препаратты дайындағаннан кейін жүргізіледі.
Іріктеп сауал бақылауын жүргізген кезде провизор технолог дәрілік препараттың құрамына кіретін алғашқы затты атайды, ал құрамы күрделі дәрілік препараттарда оның санында да көрсетеді, осыдан кейін оны дайындаған адам барлық алынған дәрілік заттарды және олардың санын атайды. Жартылай фабрикаттарды (концентраттарды) қолданған кезде фармацевт олардың құрамы мен концентрациясын да атайды.
Егер сауал жүргізуді арқылы бақылау барысында дәрілік препаратты дайындау кезінде қателік жіберілгені анықталса, онда ол физикалық және химиялық бақылауға жатады.

Органолептикалық бақылау
Органолептикалық бақылау дәрілік препаратты, оның ішінде гомеопатикалық препаратты: сыртқы түрі, түсі, иісі, біртектілігі, ерітінділердегі көзге көрінетін механикалық қосылулардың болмауы көрсеткіштері бойынша тексеруді білдіреді.
Ішуге арналған дәрілік препараттар дәміне қарай: ересектер үшін - іріктеліп және балалар үшін - міндетті түрде тексеріледі.
Ұнтақтардың, гомеопатиялық тритурациялардың, жақпамайлардың, пилюльдердің, суппозиторийлердің біртектілігі ҚР МФ талаптарына сәйкес біртекті салмағын дозаға бөлгенге дейін тексеріледі.
Әр фармацевт жұмыс күні ішінде дәрілік препараттардың әртүрлерін іріктей отырып тексеруді жүзеге асырады.

Ішінара физикалық бақылау
1) дәріханада дәрілік препараттарды (оның ішінде гомеопатиялық) дайындау кезінде жіберілетін ауытқу нормаларын және өнеркәсіптік өнімдерді өлшеп-орау кезінде жіберілетін ауытқу нормаларын сақтау үшін өнеркәсіптік өнім мен дәріханаішілік дайындаудың үш-бес қаптамасы көлемінде өлшеп-орамның әрбір сериясы, оның ішінде гомеопатиялық дәрілік препараттар өлшеп-орамы;
2) бір жұмыс күні ішінде рецептілер бойынша дайындалған, дәрілік препараттардың кемінде үш пайызы;
3) белгілі бір салмақтағы гомеопатиялық түйіршіктердің саны;
4) механикалық қоспаларға арналған (ерітінділерде кездейсоқ болатын газ көпіршіктерінен басқа қозғалыстағы ерімейтін заттар) кемінде бес құты (бөтелкеден) көлемінде оларды стерильдеуге дейінгі өлшеп-салудан кейін стерильдеуді талап ететін дәрілік препараттардың әрбір сериясы ұшырайды.

Химиялық бақылау
1) қышқылдық-сілітілік баланс мөлшерін (рН), изотоникалайтын және тұрақтандыратын заттарды қоса алғанда, стерильдеуге дейінгі инъекциялар мен инфузияға арналған ерітінділер.
Стерильдеуден кейінгі бақылау үшін әрбір сериядан бір сауыт алынады және қышқылдық-сілітілік баланс өлшемі, әсер етуші заттардың түпнұсқалығы мен сандық құрамы тексеріледі;
2) сыртқа қолдануға арналған стерильді ерітінділер (шаюға арналған офтальмологиялық ерітінділер, дененің күйген беттері мен ашық жараларды емдеуге арналған ерітінділер, қынап ішіне енгізуге арналған және басқа да ерітінділер) ;
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz