Жасушадағы энергия алмасуы және АТФ синтезі: химиялық термодинамика мен кинетика негіздері



Сабақтың тақырыбы:Жасушаның энергиямен жабдықталуы. АТФ синтезі.
Алматы, 2021 ж

Жоспар
I. Кіріспе
II. Негізгі бөлім
2. 1 Энергия алмасу кезеңдері
2. 2 Химиялық термодинамика
2. 3 Гиббстің бос энергиясы
2. 4 Химиялық кинетика
III. Қортынды
IV. Пайдаланған әдебиеттер

Кіріспе

Зат алмасу немесе метаболизм

Катаболизм (ыдырау реакциясы)

Анаболизм (синтез реакциясы)

Катаболизм және анаболизм арасындағы энергия алмасу

Зат алмасу сатылары

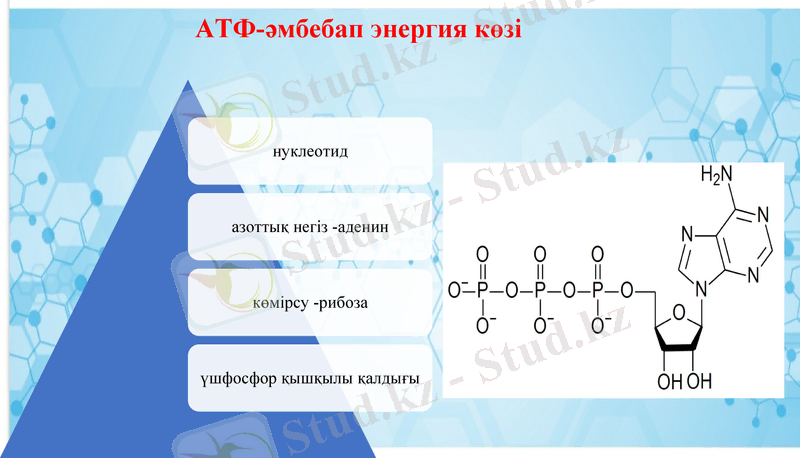
АТФ-әмбебап энергия көзі
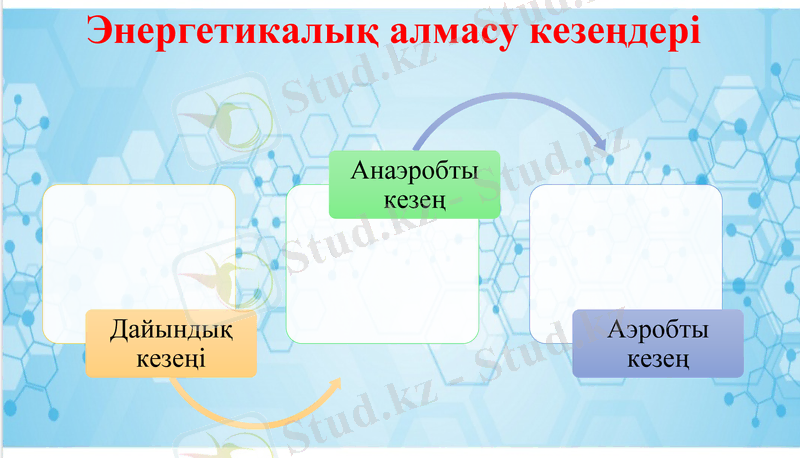
Энергетикалық алмасу кезеңдері

Дайындық кезеңі

Анаэробты кезең

Аэробты кезең
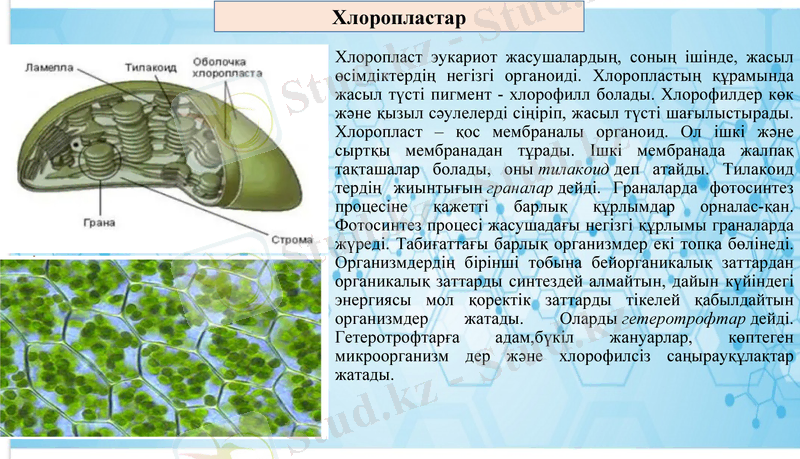
Хлоропласт эукариот жасушалардың, соның ішінде, жасыл өсімдіктердің негізгі органоиді. Хлоропластың құрамында жасыл түсті пигмент - хлорофилл болады. Хлорофилдер көк және қызыл сәулелерді сіңіріп, жасыл түсті шағылыстырады. Хлоропласт - қос мембраналы органоид. Ол ішкі және сыртқы мембранадан тұрады. Ішкі мембранада жалпақ тақташалар болады, оны тилакоид деп атайды. Тилакоид тердің жиынтығын граналар дейді. Граналарда фотосинтез процесіне қажетті барлық құрлымдар орналас-қан. Фотосинтез процесі жасушадағы негізгі құрлымы граналарда жүреді. Табиғаттағы барлық организмдер екі топқа бөлінеді. Организмдердің бірінші тобына бейорганикалық заттардан органикалық заттарды синтездей алмайтын, дайын күйіндегі энергиясы мол қоректік заттарды тікелей қабылдайтын организмдер жатады. Оларды гетеротрофтар дейді. Гетеротрофтарға адам, бүкіл жануарлар, көптеген микроорганизм дер және хлорофилсіз саңырауқұлақтар жатады.
Хлоропластар
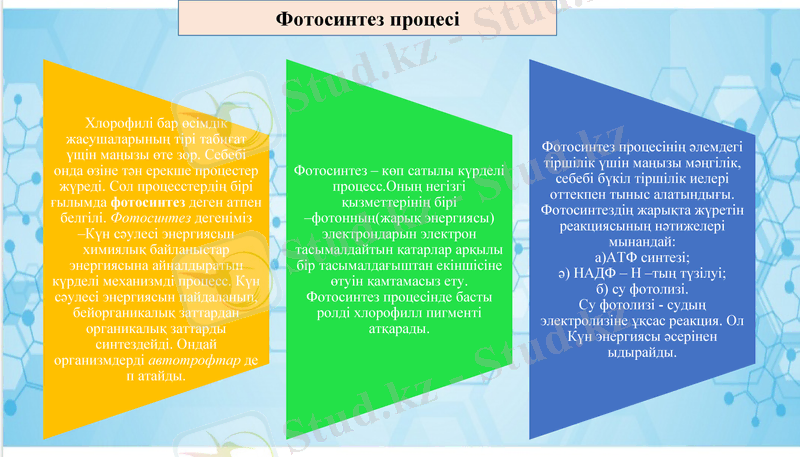
Фотосинтез процесі

Термодинамикалық жүйе - қоршаған ортадан шынайы не шартты түрде бөлінген, бір немесе өзара әрекеттесуші бірнеше денелер жиынтығы
Гомогенді жүйе (ауа)
Гетерогенді жүйе (қан)
Химиялық термодинамика - химиялық энергияның басқа бір энергия түріне айналу заңдылықтарын зерттейтін ғылыми сала
Оқшауланған жүйе - қоршаған ортамен энергиясымен де массасымен де алмаспайтын жүйе (m = 0, U = 0) .
Ашық жүйе - қоршаған ортамен энергиясымен де
массасымен де алмасатын жүйе
Жабық жүйе - қоршаған ортамен энергиясымен
алмасып, массасымен алмаспайтын жүйе

Жүйе күйі:
Термодинамикалық тұрғыдан тірі ағза:
стационарлық күйде болатын ашық гетерогенді термодинамикалық жүйе
Тірі ағзаға тән:
Жүйе параметрлерінің тұрақтылығы;
уақыт аралығында қоршаған ортамен энергия көзі мен зат алмасу процестерінің үздіксіздігі

Ішкі энергия (U) -жүйенің жалпы энергия қоры, жүйе бөлшектерінің өзара әрекеттесуі мен қозғалыстарының барлық түрін құрайды
Процесс - жүйенің бір күйден екінші күйге өту барысындағы осы жүйені сипаттайтын кез-келген бір параметрдің қайтымды не қайтымсыз өзгерісі
Биохимиялық реакциялар
р, Т = const
Процестердің жіктелуі:
Изотермиялық (Т = const, T = 0)
Изобаралық (р = const, р = 0)
Изохоралық (V = const, V =0)


Егер процесс кезінде ретсіздік өзгермесе (S = 0), онда процестің бағыты энтальпияның өзгерісімен анықталады және процесс өздігінен энтальпияның кему бағытына қарай жүреді
Егер процесс кезінде энергетикалық өзгерістер болмаса (Н = 0), онда процестің бағыты энтропияның өзгерісімен анықталады және процесс өздігінен ретсіздіктің, яғни, энтропияның арту бағытына қарай жүреді
Жүйенің энергия минимумына ұмтылуы
Жүйенің энтропия максимумына ұмтылуы

Дж. Гиббс
(1839-1903)
Процестердің өздігінен жүру шарты ретінде екі фактордың да (энтальпия және энтропия) әсерін ескеретін жүйе күйінің функциясы - Гиббстің бос энергиясы алынады
G = H - TS
Гиббстің бос энергиясы (G) - жүйенің берілген процесте атқара алатын максималды пайдалы жұмысына абсолюттік мәні жағынан тең, таңбасы жағынан қарама-қарсы болатын термодинамикалық жүйе күйінің функциясы
ΔG = -Amax
Гиббстің бос энергиясы

Пригожин принципі:
Стационарлық күйдегі термодинамикалық ашық жүйеде қайтымсыз процестердің жүру барысындағы энтропияның пайда болу жылдамдығының мәні берілген жағдайларда ең аз оң шамаға ұмтылады
∆Si/∆z→0
Пригожин И. Р.

Химиялық кинетика
химиялық реакциялардың жылдамдығын;
химиялық реакциялардың жүру механизмін;
реакция жылдамдығының түрлі факторларға тәуелділігін
зерттейтін ғылыми сала
Химиялық кинетика
Бастапқы заттар
Реакция өнімдері

Химиялық реакцияның жылдамдығы
бірлік көлемде немесе бірлік ауданда бірлік уақыт ішінде әрекеттесетін молекулалар саны
моль/лсек

Химиялық реакцияның жылдамдығына
әсер етуші факторлар:
әрекеттесуші заттардың табиғаты;
әрекеттесуші заттардың концентрациясы;
температура;
катализатордың қатысы

Қорытынды
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz