Тұздардың гидролизі: түрлері, механизмдері және қолданбалы маңызы



Тұздар гидролизі

Кейбір тұздардың суда диссоциацияланғанда түзілген гидраттанған катиондары немесе аниондарының су молекуласымен сәйкесінше қышқылды немесе сілтілі орта түзе әрекеттесуі тұздардың гидролизі деп аталады.

Сандық жағынан гидролизді гидролиздену дәрежесі (h) арқылы өрнектейді
h=гидролизденген молекулар саны
молекулалардың жалпы саны
Температураны арттырып және ерітінді сұйылту арқылы гидролиздену дәрежесін өсіруге болады.

Гидролиз процесіне құрамында әлсіз қышқыл немесе әлсіз негіздің иондары бар тұздар ғана түседі. Ал күшті қышқылдар мен күшті негіздердің әрекеттесуінен түзілген тұздар (NaCl, KNO3, BaCl2 және т. б. ) гидролизденбейді. Себебі, олардың гидраттанған иондары су молекуласымен әрекеттеспейді және нәтижесінде әлсіз электролит түзілмейді.

Тұздардың табиғатына байланысты үш түрлі
гидролиздену реакциясы болады:
1. Күшті қышқыл мен әлсіз негіздің әрекеттесуінен түзілген тұздардың CuCl2, NH4Cl, Al2(SO4) 3 және т. б. гидролизі. Бұл жағдайда гидролиз реакциясына, яғни тұздың құрамындағы гидраттанған катион мен су молекуласы әрекеттеседі де, нәтижесінде түзілген оксоний ионына байланысты ерітінді қышқылды (рН < 7) болады. Мысалы AlCl3 тұзы суда ерігенде диссоциацияланып, иондарға толық ыдырайды:
Диссоциациялану теңдеуі:
AlCl3 → Al3+ + 3Cl-
HOH → H+ + OH
Al3+ + 3Cl- + HOH → Al(OH) 2+ + H+ + 3Cl-
Гидролиз реакциясының иондық теңдеуі:
Al3+ + 3Cl- + HOH → Al(OH) 2+ + H+ + 3Cl-
Гидролиз реакциясының молекулалық теңдеуі:
AlCl3 + H2O → Al(OH) Cl2 + HCl
Ерітіндіде Al3+ ионы су молекуласынан гидроксид-ионды OH- оңай қосып алып, өте нашар диссоциацияланатын (Al(OH) 3-ке қарағанда) Al(OH) 2+ ионына ауысады. Мұның нәтижесінде судың келесі молекуласы диссоциацияланады. Сонымен, ерітіндіде сутегі иондарының көбеюіне әсер етеді.
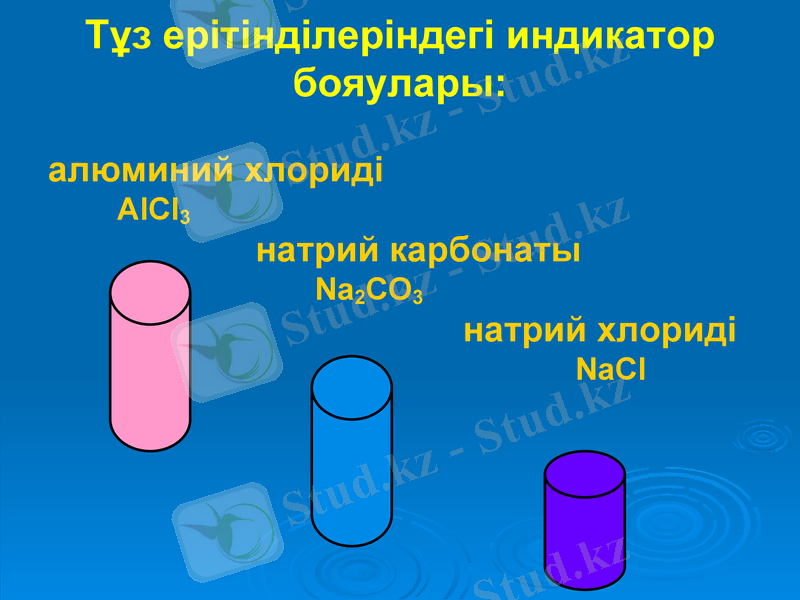
Тұз ерітінділеріндегі индикатор бояулары:
алюминий хлориді
AlCl3
натрий карбонаты
Na2CO3
натрий хлориді
NaCl
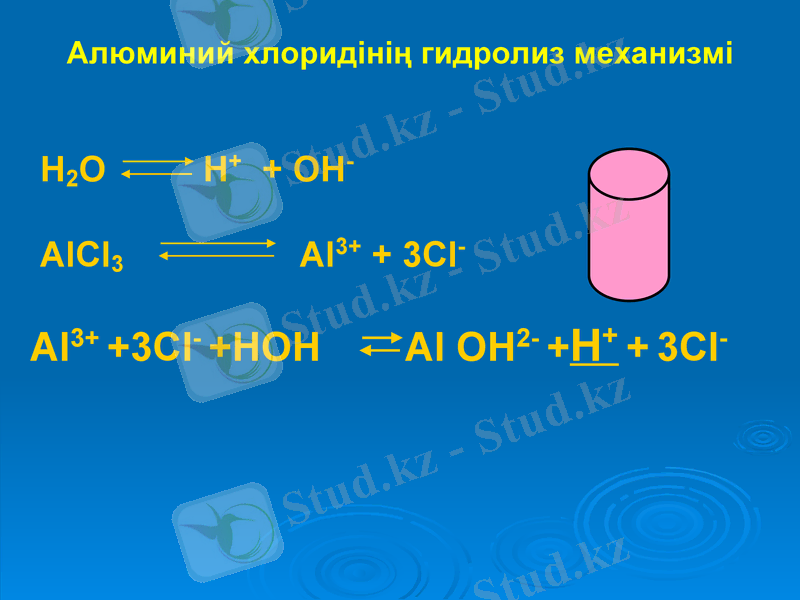
Алюминий хлоридінің гидролиз механизмі
H2O H+ + OH-
AlCl3 Al3+ + 3Cl-
Al3+ +3Cl- +HOH Al OH2- +H+ + 3Cl-
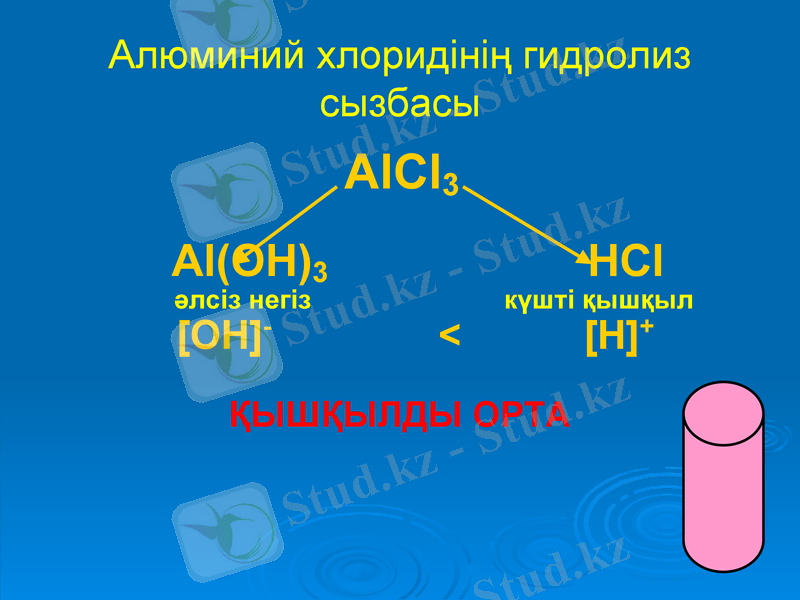
Алюминий хлоридінің гидролиз сызбасы
AlCl3
Al(OH) 3 HCl
әлсіз негіз күшті қышқыл
[OH] - < [H] +
ҚЫШҚЫЛДЫ ОРТА

2. Әлсіз қышқыл мен күшті негіздердің әрекеттесуінен түзілген тұздардың CH3COONa, Na2CO3, KCN, Na2SO3, KNO2 және т. б. гидролизі. Бұл жағдайда гидролиз реакциясына тұздың құрамындағы әлсіз қышқылдың қалдығы болып саналатын гидраттанған анион түседі де, нәтижесінде ерітінді сілтілі (рН > 7) болады.
Диссоциациялану теңдеуі:
Na2CO3 ⇄ 2Na+ + CO32-
H2O ⇄ H+ + OH-
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының иондық теңдеуі:
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының молекулалық теңдеуі:
Na2CO3 + H2O ⇄ NaOH + NaHCO3
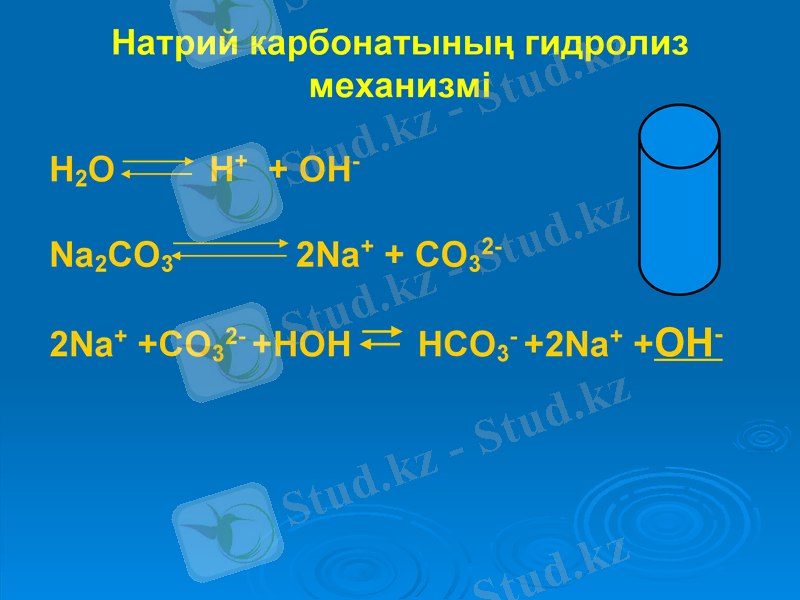
Натрий карбонатының гидролиз механизмі
H2O H+ + OH-
Na2CO3 2Na+ + CO32-
2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
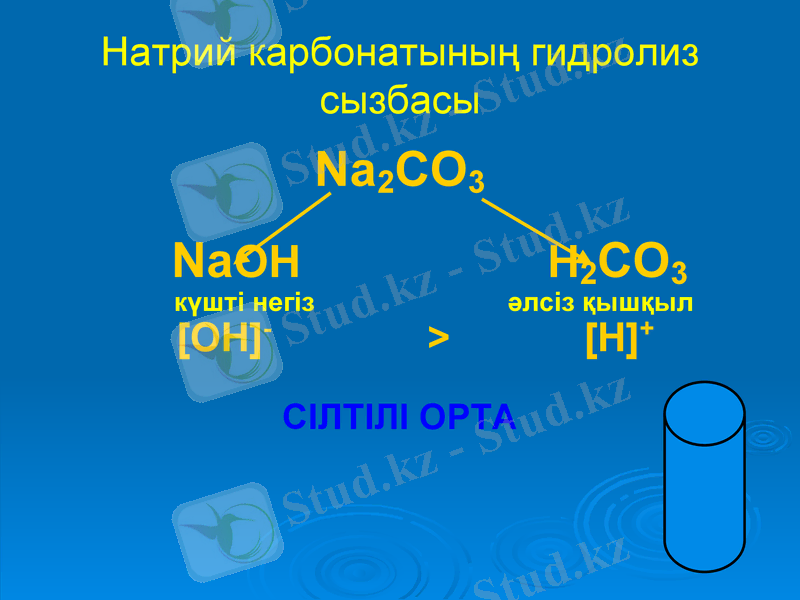
Натрий карбонатының гидролиз сызбасы
Na2CO3
NaOH H2CO3
күшті негіз әлсіз қышқыл
[OH] - > [H] +
СІЛТІЛІ ОРТА
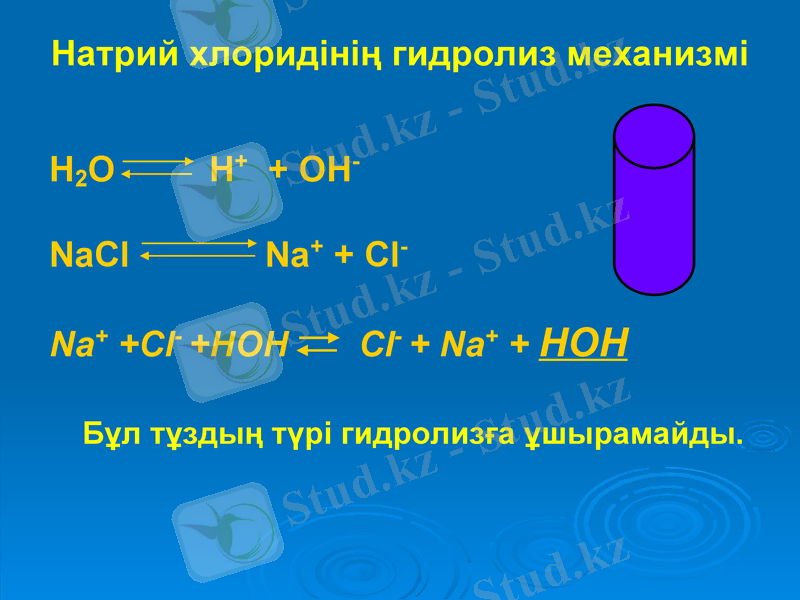
Натрий хлоридінің гидролиз механизмі
H2O H+ + OH-
NaСl Na+ + Cl-
Na+ +Cl- +HOH Cl- + Na+ + HOH
Бұл тұздың түрі гидролизға ұшырамайды.
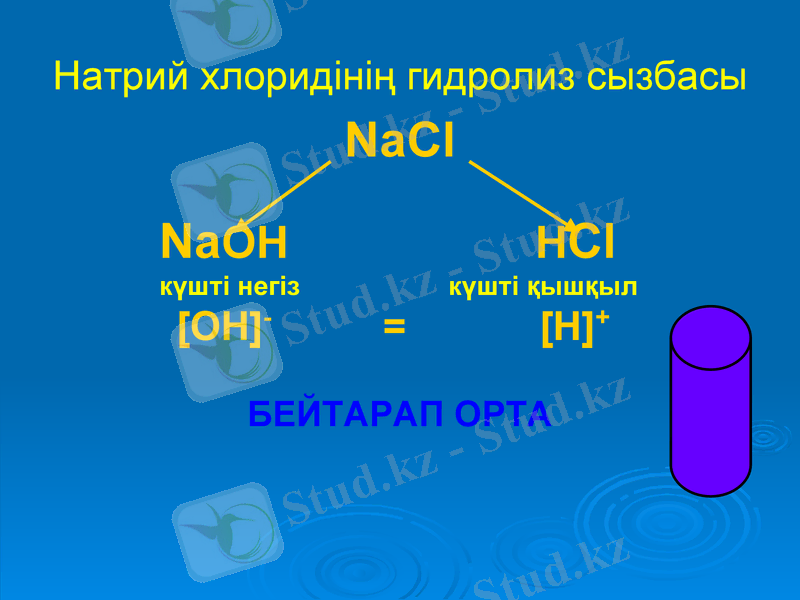
Натрий хлоридінің гидролиз сызбасы
NaCl
NaOH HCl
күшті негіз күшті қышқыл
[OH] - = [H] +
БЕЙТАРАП ОРТА

3. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздар да гидролизге ұшырайды. Бұл жағдайда гидролиздену процесі соңына дейін жүріп, қышқыл мен негіз түзіледі. Мысалы, алюминий сульфиді Al2S3 сумен әрекеттескенде алюминий гидроксиді Al(OH) 3 мен күкіртсутек H2S түзіліп, гидролиздену реакциясы қайтымсыз болады:
Al2S3 + 6H2O = 2Al(OH) 3↓ + 3H2S↑
Олай болса, тұздардың гидролизге ұшырауы, олардың иондарының құрамы мен мен қасиетіне байланысты.

Гидролиздің қоғамдық өмірдегі мәні
Шикі бағалы өнімдерді даярлау (қағаз, сабын, спирт, глюкоза, ақуыздық ашытқылар)
Өндірістік ағыс және ішімдік суларды тазалау
(алюминий сульфаты + алюминий гидроксиді)
Маталарды бояуға даярлау

Гидролиздің күнделікті адам өміріндегі рөлі
Кір жуу
Ыдыс-аяқ жуу
Сабынмен жуыну
Ас қорыту процессі

Назар аударғандарыңызға рахмет!!!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz