Қазақстан Республикасының мемлекеттік фармакопеясы: мазмұны, құрылымы және фармакопеялық мақалалар



ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ Е. А. БӨКЕТОВ АТЫНДАҒЫ ҚАРАҒАНДЫ МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
«ДӘРІЛІК ЗАТТАРДЫ СТАНДАРТТАУ ЖӘНЕ САПАСЫН БАҚЫЛАУ»
ДӘРІС №3 ТАҚЫРЫБЫ: ФАРМАКОПЕЯЛЫҚ БАПТАР
5В074800-- «ФАРМАЦЕВТИКАЛЫҚ ӨНДІРІС ТЕХНОЛОГИЯСЫ» МАМАНДЫҒЫ
ОМАШЕВА А. В- ОРГАНИКАЛЫҚ ХИМИЯ ЖӘНЕ ПОЛИМЕРЛЕР КАФЕДРАСЫНЫҢ ДОЦЕНТІ
САБАҚ ТҮРІ (ДӘРІС) ҚАРАҒАНДЫ -2019 Ж.

Қолданатын әдебиеттер тізімі
Арыстанова Т. Ә. Жалпы фармацевтикаклық химия. - Алматы, Эверо, 2914. - 287 с.
Музычкина Р. А., Корулькин Д. Ю., Пичхадзе Г. М. Избранные главы фармацевтической химии: монография. - Алматы: ЦДК «Глобус», 2014. - 360 с.
Молчанов Г. И. Фармацевтические технологии: современные электрофизические технологии биотехнологии в фармации: учебное пособие. - М. : Альфа-М: ИНФРА-М, 2011. - 336 с.
Минина С. А., Каухова И. Е. Химия и технология фитопрепаратов: учебное пособие. - М. : ГЭОТАР-Медиа, 2009. - 560 с.
Арыстанова Т. А., Ордабаева С. К. Стандартизация лекарственных средств: учебное пособие. - Шымкент: Издательство ЮКМУ, 2002, - 98 с.

ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ МЕМЛЕКЕТТІК ФАРМОКОПЕЯСЫ

МАЗМҰНЫ:
Тарихы;
ҚР Мемлекеттік фармакопеясы туралы жалпы түсінік;
ҚР МФ жұмыс істеу механизмі;
ҚР МФ I және II томы;
ҚР МФ құрылымы;
ҚР МФ мәртебесі;
ҚР МФ-ның Еуропа фармакопеясынан ерекшелігі;
Еуропалық, және басқа фармокепядан айырмашылығы;
ҚР МФ пайдаланушылары.

Тарихы
Қазақстанның Ресей құрамында, сосын Кеңес Одағының құрамында болған кезеңінде дәрілік заттардың сапасына мемлекеттік бақылау Орыс мемлекеттік фармакопеясының, ал 1926 жылдан кейін, - КСРО Мемлекеттік фармакопеясының стандарттары мен ережелері негізінде жүргізілді. КСРО МФ соңғы - Х (1969 ж. ) және XI басылымдары (1987 ж. - 1 бас., 1990 ж. - 2 бас. ) республикада күні бүгінгі күнге дейін өзінің заңды сипатын сақтап келді.
Дәрілік заттар сапасының ұлттық стандартын - Қазақстан Республикасының Мемлекеттік фармакопеясын жасаудың қажеттілігі алғаш рет 2004 жылғы 13 қаңтардағы № 522 «Дәрілік заттар туралы» Заңда көрсетілді.

ҚР Мемлекеттік фармакопеясы туралы жалпы түсінік
«Дәрілік заттар туралы» заңға сәйкес Қазақстан Республикасының Мемлекеттік фармакопеясы - бұл белгіленген тәртіппен тіркелген және қолданысқа рұқсат етілген дәрілік заттардың сапасы мен қауіпсіздігін қалыпқа келтіретін мемлекеттік стандарттар мен ережелердің жиынтығы.
Онда:
Аптекада міндетті түрде болуға тиісті дәрілік заттардың тізімі;
Олардың тазалығын тексеру тәсілдері туралы нұсқаулар;
Олардың физикалық-химиялық қасиеттері туралы қысқаша мәліметтер;
Улы және күшті әсер ететін заттардың бір мезгілдік; тәуліктік және ең жоғарғы дозалары туралы мәліметтер;
Оларды сақтау тәсілдері, кейбір дәрі түрлерін дайындау ережелері және басқа нұсқаулар.

Фармакопея фармацевт пен дәрігер үшін міндетті заңдардың жинағы сияқты болып келеді. Фармакопеялық комиссия тарапынан фармакопея қайта қаралып отырылады.
Фармакопеяға енгізілген барлық препараттар үш топқа бөлінеді:
А - тобы - улы заттар. Олар аузына құлып салынған жеке шкафта сақталады. Улы дәрілік заттар құйылған шөлмектің сыртындағы қара қағазға ақ түсті әріптермен жазылады. Шкафтардың (сейфтердің) ішкі қабырғасына сақтаулы тұрған улы дәрілік заттардың тізімі мен қанша бар екендігі жазылып қойылуы керек;
Б - тобы - күшті әсер ететін заттар. Бұларда құлып салынған жеке шкафта сақталады. Күшті әсер еткіш заттар құйылған шөлмектің сыртындағы ақ қағазға қызыл түсті әріптермен жазылады;
Улы және қатты әсер ететін дәрілік заттардан басқа дәрілер (жай әсер ететін), кәдімгі шкафтарда жалпы ережелер бойынша сақталады. Шөлмектің сыртындағы жазу ақ фонда, қара түсті әріптермен жазылады. Дәріханаларда дәрілік зат формаларының жапсырма қағазыда әр түсті болады. Ішуге арналған дәрілердің жапсырма қағазы ақ, сыртқа қолданатын дәрілердікі көк түсті.
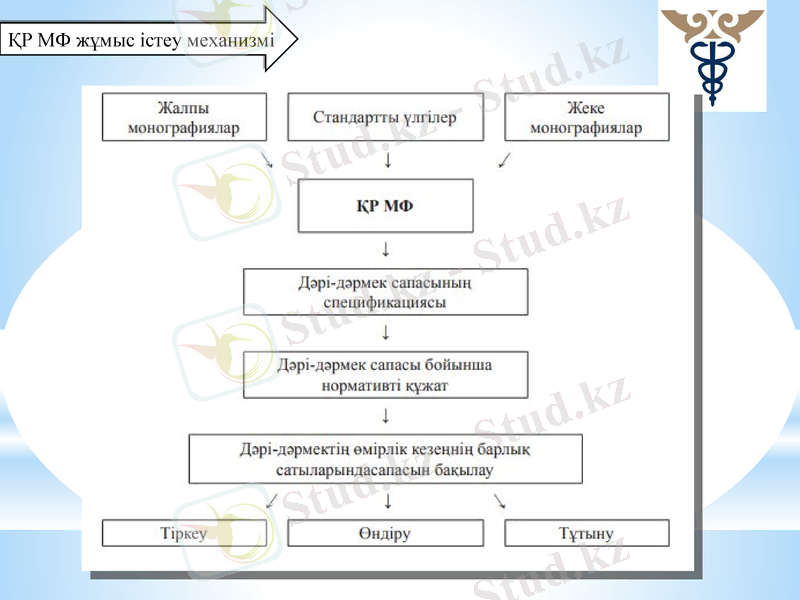
ҚР МФ жұмыс істеу механизмі

ҚР МФ I және II томы
Мемлекеттік тапсырыс бойынша ҚР МФ екі томы мемлекеттік және ресми тілде шығарылған.
ҚР МФ I томында жалпы фармакопеялық мақалалар енгізілген;
ҚР МФ II томында жеке фармакопеялық мақалалар (монографиялар)

Жалпы фармакопеялық мақалалардың ішінде төмендегілер үшін берілетін жалпы талаптар айтылады:
сынақ әдістері;
қаптамалық материалдар мен контейнерлер;
реагенттер;
сапа көрсеткіштері;
дәрілік түрлер;
дәрілік өсімдік шикізаттарының морфологиялық топтары;
медицинлық иммунобиологиялық препараттар.
Жеке фармакопеялық мақалалар (монографиялар) сапа көрсеткіштеріне қойылуы қажет талаптарды регламенттейді және сапаны бақылау үшін сынақ әдістемелерін белгілейді:
дәрілік субстанциялардың;
қосымша заттардың;
дәрілік препараттардың;
дәрілік өсімдік шикізаттарын;
медициналық иммунобиологиялық препараттарды.
ҚР МФ I және II томы

Фармакопея құрылымы мақалаларды екі, жалпы және жеке бөлімге бөлуді қарастырады.
Біріншісі жалпы бөлімі деп аталып, Еуропа фармакопеясындағы сәйкес еуропалық бөлім деп аталады. Келесі бөлімі Қазақстан Республикасының елтаңбасымен белгіленген, ұлттық деп аталып, республикадағы дәрілік заттардың сапасының ұлттық тұрғыдан алғандағы ерекшеліктерін көрсетеді.
Жалпы (еуропалық) бөлігінде GMP ережелеріне сәйкес өндірілген дәрілік заттардың сапасына қойылатын талаптар айтылған. Тұтас алғанда мұнда Еуропа фармакопеясының стилі сақталады. Оны жазуда елеулі дәрежеде түпнұсқадағы мәтінге ұқсастыққа қол жеткізілді, мәтін мемлекеттік және орыс тілінің стилистикасына бейімделді, ал одан ары - мәтін отандық нормативтік құжаттамаларға тән стильге түсірілді.
Ұлттық бөлімінде GMP ережелеріне сәйкес өндірілмеген дәрілік заттарға қойылатын талаптар. Оған баламалы әдістемелер, қосымша ақпараттық материалдар да кіреді. Оның мазмұны жалпы (еуропалық бөліміне) бөлімге қарама-қайшы келмейді, тек оны толықтырып отырады.
ҚР МФ құрылымы

Қазақстан Ресупбликасының мәртебесі
Еуропалық Фармакопеялық Комисияның ресми бақылаушысы
Америкалық фармакопеялық Конвенцияның мүшесі
Бақылаушы мәртебесі төмендегі міндеттердің шешімін табуға мүмкіндік береді:
Дәрілік заттардың сапасын бақылау мен сынақ әдістері саласында еуропалық тәжірибенің негізінде өзіндік тәжірибелерін жинақтауға;
Осы саладағы ұлттық ерекшеліктер мен даму жолдарын анықтауға;
Еуропа фармакопеясының ықпалымен, қамқорлығымен өткізілетін ғылыми зерттеулерге атсалысуға.

Қазақстан Республикасы Мемлекеттік фармакопеясының Еуропа фармакопеясынан ерекшеленетін белгілері төмендегілер болып табылады:
әр мақалада дерлік ұлттық ерекшеліктердің көрінуі;
дайын дәрілік заттарға монографиялардың әзірленуі (Еуропа фармакопеясының басылымдарында дайын дәрілік заттарға монографиялар жоқ екені жалпыға белгілі) ;
дәрілік өсімдік шикізаттарының морфологиялық топтарына монографиялардың әзірленуі.

II ДӘРЕЖЕ.
Еуропалық фармакопея
I ДӘРЕЖЕ. ҚР МФ
III ДӘРЕЖЕ. Британдық және
АҚШ фармакопеясы
ҚР МФ-ның басқа фармакопеялармен үйлесімі
Республикада қазіргі фармакопея стандарттарын қолдану олардың артықшылық ұстанымдары бойынша жүзеге асырылады.
Артықшылықтың бірінші деңгейі Қазақстан Республикасында дәрі-дәрмектер сапасының басты ұлттық стандарты ретінде ҚР МФ-на беріледі. Онда монографиялар болмаса немесе кешеуілдеп шығарылған болса, ҚР МФ үйлестірілген басқа фармакопеялардың сәйкес монографиялары, базалық фармакопея ретінде Еуропа фармакопеясы (екінші деңгей), АҚШ Фармакопеясы және Британ фармакопеясы (үшінші деңгей) қолданылады.

Негізгі фармакопеяларымен үйлестірудің міндетті шарты олардың патент иелерінің авторлық құқықтарын сақтау болып табылады, бұл фармакопеялық мәтіндерді үйлестіруге ресми рұқсат алуды талап етеді. Осы шартқа сәйкес 2007 жылы Еуропа Кеңесінің дәрі-дәрмектер сапасы бойынша Еуропа директоратының (EDQM) рұқсаты алынған, 2010 жылы АҚШ Фармакопеялық конвенциясымен (USP) келісім жасалған және 2014 жылы дәрі-дәрмектер айналымын және денсаулық сақтау өнімдерін реттеу бойынша Ұлыбритания Агенттігімен (MHRA) келісім жасалған. Осылайша, қазіргі кезде ҚР МФ үш негізгі фармакопеяларымен - Еуропа фармакопеясымен, АҚШ Фармакопеясымен және Британ фарма- копеясымен үйлестірілген.
Мемлекеттік фармакопея материалы мүмкіндігінше Еуропа фармакопеясының оқылымына жақын мағынада жазылған. Бөлімдерінің нөмірленуі мен монографиялардың атаулары, заттектердің химиялық атаулары, физикалық шамалардың өлшем бірліктері, есептеу формулалары да Еуропа фармакопеясындағымен бірдей деуге болады. Тек өлшем бірліктерінің белгіленуі ғана отандық нормативтік құжаттамада пайдаланылуының дәстүрлілігіне орай өзгеріске ұшыраған. Сол бағытта аббревиатуралар мен қысқартылған сөздердің шеңбері де кеңітілген.
ҚР МФ-ның басқа фармакопеялармен үйлесімі
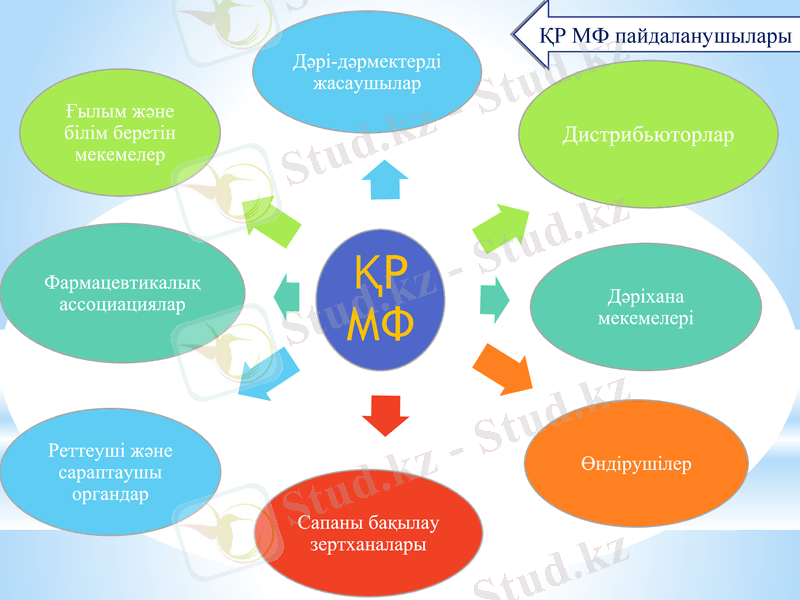
ҚР МФ пайдаланушылары

Фармакопеялық статья дегеніміз не?
Фармакопеялық статья (ФС) - бұл нормативтік-техникалық құжатқа қойылатын талаптарды белгілейтін дәрілік заттың сапасына немесе дәрілік өсімдік шикізаты, оны орау, сақтау шарттары мен мерзіміне, сапасын бақылау әдістеріне бекітетін уәкілетті федералдық атқарушы билік органдарымен және мемлекеттік стандарттын шынайы сипатына қарай ұстанады .
Фармакопеялық статьяның құрамында: дәрілік өсімдік шикізаттың атауын орысша немесе латын тілінде жазылады (сонымен қатар латын тіліндегі дәрілік өсімдік шикізаттың атауын халықаралық атауғада жатқызады)

Фармакопеялық статья (түрлері)
Фармакопеялық статьяның кәсіпорны (ФСК)
-Бұл сапалы стандартты дәрілік заттың сауда атауы бойынша, тізбегін қамтитын әдістер мен көрсеткіштері дәрілік заттың сапасын бақылайтын өндірістің нақты кәсіпорны ескеріледі, сонымен қатар кәсіпорын өткен сараптама және белгіленген тәртіппен Мемлекеттік Фармакопеясымен сәйкес жазылады, ол сапа көрсеткіштері Мемлекеттік Фармакопея бойынша тиісті талаптардан төмен болмау керек.
Кәсіпорынның фармакопеялық статьяларының (фармацевтикалық) қолданылу мерзімі 5 жылдан аспайтын мерзімде бекітілсе, дәрілік заттың нақты өндірісінің технологиялық процесінің деңгейі ескеріледі.

Жалпы фармакопеялық статья (ЖФС)
Бұл дәрі-дәрмектердің мемлекеттік сапа стандарты, дәрілік фармға қойылатын топтарды құрайтын, сонымен қатар дәрілердің стандартты әдістеме сипаттамасы. ЖФС өзіне нормалық өлшемдердің тізімін санымен қатар белгілі бір дәрілердің сынақ әдістерін қамтиды, химиялық сипаттама, физикалық, физика-химиялық, биологиялық, биохимиялық, микробиологиялық дәрілердің талдау әдістемелері, бұған қоспалар, реактивтерге, индикаторларға қойылатын талаптарда енгізілген.
Кәсіпорынның ФС, ЖФС Фармакопеялық статьялары Департамент басшымен бекітіледі, сонынан мекемеде тіркеліп, ҚР-ның денсаулық сақтау Министірлігінен бекітіледі.

Жеке фармакопеялық статья (ЖФС)
-Бұл нормативті-техникалық құжат, дәрілік құралдардың сапасы мен қауіпсіздігі регламенттейді.
Уақытша фармакопеялық статья (УФС) :
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz