Электролиз, Фарадей заңдары және потенциометрияның фармациялық өндірістегі қолданылуы



Электролиз. Фарадей заңдары. Потенциометрия. Әдістің фармациялық өндірісте қолданылуы
Алматы, 2021
ҚЕАҚ С. Ж. Асфендияров атындағы Қазақ Ұлттық медицина университеті
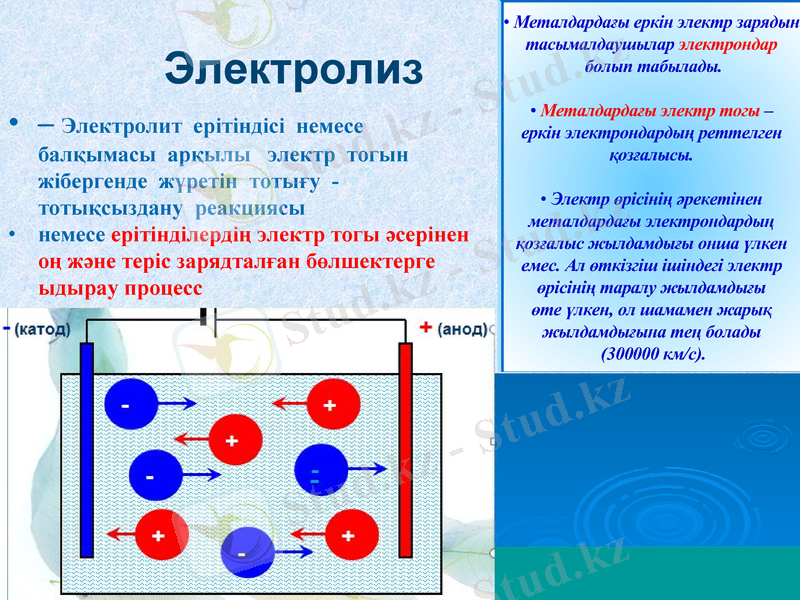
Электролиз
- Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін тотығу - тотықсыздану реакциясы
немесе ерітінділердің электр тогы әсерінен оң және теріс зарядталған бөлшектерге ыдырау процесс
.
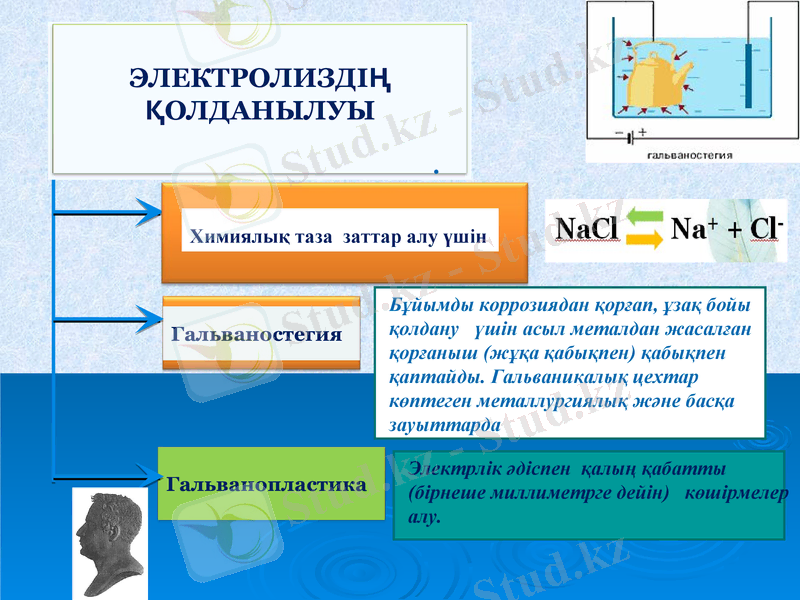
Бұйымды коррозиядан қорғап, ұзақ бойы қолдану үшін асыл металдан жасалған қорғаныш (жұқа қабықпен) қабықпен қаптайды. Гальваникалық цехтар көптеген металлургиялық және басқа зауыттарда
Электрлік әдіспен қалың қабатты (бірнеше миллиметрге дейін) көшірмелер алу.

1834 жылы ағылшын ғалымы Майкл Фарадей электролиз зерттеп, оның заңдылықтарын ашты.
Майкл Фарадей (1791 - 1867)
Электролиздің бірінші заңы
Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен зарядтың мәніне тура пропорционал
k - заттың электрохимиялық эквиваленті
(электролит арқылы 1Кл заряд өткен кезде бөлініп шыққан заттың массасына тең
«Электролит», «электрод», «анод», «катод» терминдерін енгізді.

Электролиздің екінші заңы
Электр тогының бірдей мөлшерінде (электролит арқылы өткен электр заряды) электролиз кезінде бөлінген заттардың массасы, заттардың молярлы массасының валенттілігі қатынасына пропорционалды болады.
M - бөлінген заттың массасы
k - электрохимиялық эквивалент М - заттың молярлық массасы
z -заттың валенттілігі
Барлық электролиттер үшін бірдей 1 моль затты бөлуге арналған заряд. Ол F Фарадей саны деп аталады.
Электрохимиялық эквивалент пен Фарадей саны қатынаспен байланысты
Металдар табиғатта
Тас тұз
Глаубер тұз
сильвинит
карналлит
белсенді
Белсенділігі орташа
асыл
NaCl -ас (тас) тұзы
Na2SO4 * 10H2O - глаубер тұзы
NaCl*KCl - сильвинит
KCl * MgCl2*6H2O - карналлит
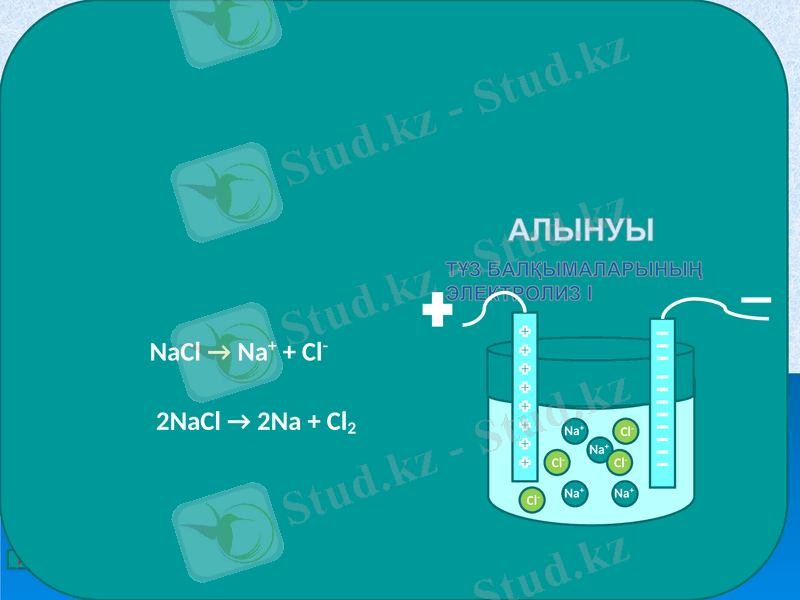
АЛЫНУЫ
ТҰЗ БАЛҚЫМАЛАРЫНЫҢ Электролиз І
NaCl → Na+ + Cl-
2NaCl → 2Na + Cl2

Электролит ерітінділерінің
Электролиз І

Сулы электролит ерітінділердегі катодтық процесстер
Металдардың электрохимиялық кернеу қатары
Li, K, Ba, Ca, Na, Mg, Al
Mn, Zn, Cr, Fe,
Cd, Co, Ni
Н
Cu, Hg, Ag, Pt, Au
Су молекулаларының тотықсыздануы:
2H2O + 2e- = Н2↑ + 2ОН-
Екі процесс те жазылады:
Men+ + ne- =
Me0
2) 2H2O + 2e- = Н2↑ + 2ОН-
Металл катионының тотығуы:
Men+ + ne- = Me0

Сулы электролит ерітінділердегі анодтық процесстер
Қышқыл қалдығының анионы Аm-
Оттегісіз
(Cl-, Br-, I-, S2- т. б. ., тек фтордан басқасы F-)
Оттегі құрамдас
( ОН-, SO42-, NO3-,
CO32- т. б. ) и F-
Анионның тотығуы
(фторид ионынан басқасы)
Аm- me- = А0
Қышқылдық және бейтарап ортада - сутегі молекуласының тотығуы:
2H2O - 4e- = O2↑ + 4H+
Сілітілік ортада:
4OH- 4e- = O2↑ + 2H2O

Аниондардың тотықсыздану белсенділігінің өзгеруі
Аниондар қабілетіне байланысты келесідей ретте тотығады:
I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, F-
Тотықсыздану белсенділігі төмендейді
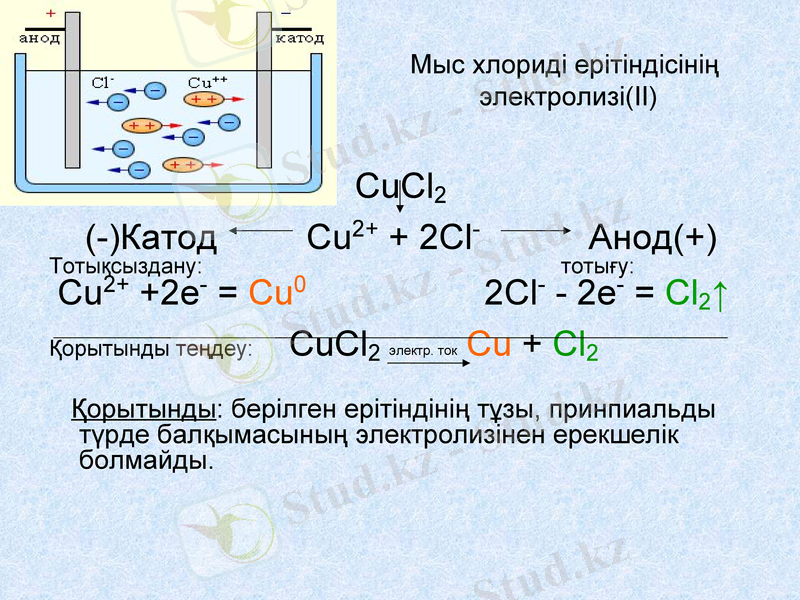
Мыс хлориді ерітіндісінің электролизі(II)
CuCl2
(-) Катод Cu2+ + 2Cl- Анод(+)
Тотықсыздану: тотығу:
Cu2+ +2е- = Сu0 2Cl- 2е- = Cl2↑
Қорытынды теңдеу: CuCl2 Сu + Cl2
Қорытынды: берілген ерітіндінің тұзы, принпиальды түрде балқымасының электролизінен ерекшелік болмайды.
электр. ток
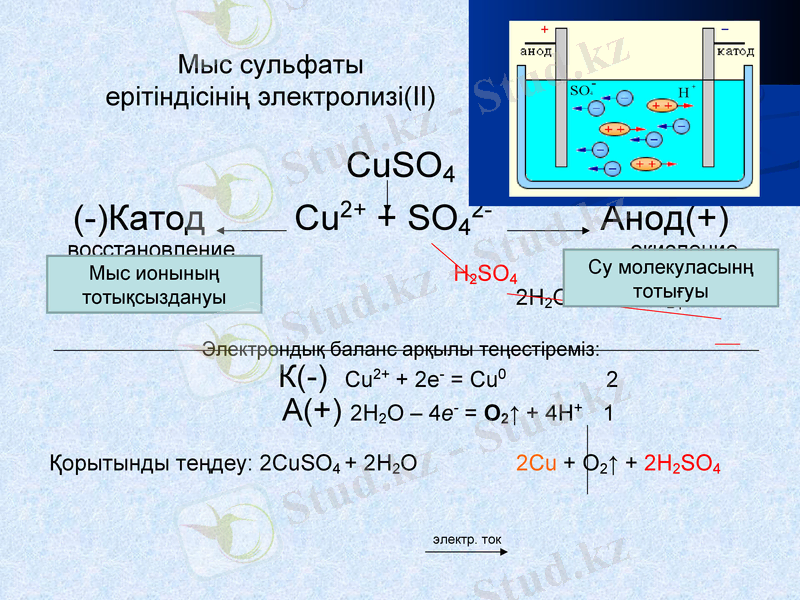
Мыс сульфаты ерітіндісінің электролизі(II)
CuSO4
(-) Катод Cu2+ + SO42- Анод(+)
восстановление окисление
ионов меди: H2SO4 молекул воды:
Cu2+ + 2е- = Сu0 2H2O - 4e- = O2↑ + 4H+
Электрондық баланс арқылы теңестіреміз:
К(-) Cu2+ + 2е- = Сu0 2
А(+) 2H2O - 4e- = O2↑ + 4H+ 1
Қорытынды теңдеу: 2CuSO4 + 2H2O 2Cu + O2↑ + 2H2SO4
электр. ток
Мыс ионының тотықсыздануы
Су молекуласынң тотығуы

Калий иодиді ерітіндісінің электролизі
KI
(-) Катод K+ + I- Анод(+)
Восстановление KOH окисление анионов
молекул воды: иода:
2H2O + 2e- = Н2↑ + 2ОН- I- e- = I0 ; 2I = I2
Электрондық баланс әдісі арқылы теңестіреміз:
К(-) 2H2O + 2e- = Н2↑ + 2ОН- 1
А(+) 2I- 2e- = I20 ; 1
Қорытынды теңдеу: 2KI + 2H2O Н2↑ + I2 + 2KOH
электр. ток
Иод анионының ионының тотығуы
Су молекуласынң тотықсыздануы

Натрий сульфаты ерітіндісінің электролизі
Na2SO4
(-) Катод 2Na+ + SO42- Анод(+)
восстановление окисление
молекул воды молекул воды
2H2O + 2e- = Н2↑ + 2ОН- 2H2O - 4e- = O2↑ + 4H+
Сілітілік орта қышқылдық орта
Қорытынды теңдеу : 2H2O 2H2↑ + O2↑
Қорытынды :Натрий сульфаты ерітіндісінің электролизі судың ыдырауына алып келеді: осы тұздың электролизі электрөткізгіштікті жоғарылау үшін қолданылады, себебі су өте әлсіз электролит болып табылады.
электр. ток
Су молекуласынң тотықсыздануы
Су молекуласынң тотығуы

MgCl2 ерітіндісі үшін
К: 2H2O + 2e → H20 + 2OH-
A: 2Cl- 2e → Cl20
MgCl2 + 2H2O → H2 + Cl2 + Mg(OH) 2
ZnSO4 ерітіндісі үшін
(-) Катод: 2H2O + 2ē = H2↑+ 2OH-
Zn2+ + 2ē = Zn0
(+) Анод: 2H2O - 4ē = O2↑+ 4H+
MgCl2 және ZnSO4 ерітінділері үшін
К: 2H2O + 2e → H20 + 2OH-
Zn2+ + 2e → Zn0
A: 2Cl- 2e → Cl20
2H2O - 4e → O20 + 4H+
Қорытынды теңдеу:
MgCl2 + 2ZnSO4 + 4H2O → H2 + O2 + Cl2 + 2Zn + Mg(OH) 2 + 2H2SO4
Магний хлориді және мыс сульфаты ерітінділерінің электролизі

Потенциометрия
(лат. Potentia- күш, әрекет; грек. metreo-өлшеймін)
Гальваникалық элементтердің ЭҚК-н өлшеуге негізделген, физиология, медицина, биохимия, биология және басқа лабороториялық салаларда кеңінен қолданылатын жаңашыл зерттеу әдісі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz