ІІ топтың (сілтілік жер) металдары: электрондық құрылысы, химиялық қасиеттері және қолданылуы



Сабақтың тақырыбы

Сабақтың мақсаты:
Білімділік:
ІІ-топтың негізгі топша металдарына
жалпы сипаттама беру,
Д. И. Менделеевтің периодтық
жүйесінің негізгі топшасындағы
кальций мен магний металдар
жайында алған білімдерін кеңейту
және тереңдету.
Тәрбиелік:
Оқушыларды қоршаған ортаны
қорғауға, ұжымдық жұмыс
істеу қабілетіне, ізденімпаздыққа,
жауапкершілікке тәрбиелеу.
Дамытушылық:
Металдардың қасиеттерін,
маңызын талдау, реакция
теңдеулері арқылы жаза
білуді әрі қарай дамыту,
қорытындысын шығаруға
үйрету. Химия пәнінен алған
білімдерін жетілдіру, өз бетінше
іздену қабілетін дамыту.

Ой қозғау
?
Na
Na2O
Li2O
?
O2
O2
?
K
?
?
Na2S

Сәйкестендіру тесті.
1. NaOH а) бертолле тұзы
2. KMnO4 ә) натрий сульфаты
3. KClO3 б) ас тұзы
4. Na2SO4 в) натрий гидрокарбонаты
5. NaHCO3 г) калий перманганаты
6. NаCI д) күйдіргіш натр

Тіл- өнері
1. РОЫНҚАҒС
2. АСПЫН
3. АЫҚЙАЛ
4. ҮМКСІ

«Мен кіммін»
1. Ең қатты металл
2. Ең қиын балқитын металл
3. Сұйық металл
4. Ең иілімді металл
5. Ең жеңіл металл
6. Ең ауыр металл

“Ой қозғау”
ІІ топтың негізгі топшасындағы элементтерді ата?

Атомдардың электрондық формулалары
+4Be …2s2
+2Mg…3s2
+20Ca…4s2
+38Sr…5s2
+56Ba…6s2
+88Ra…7s2
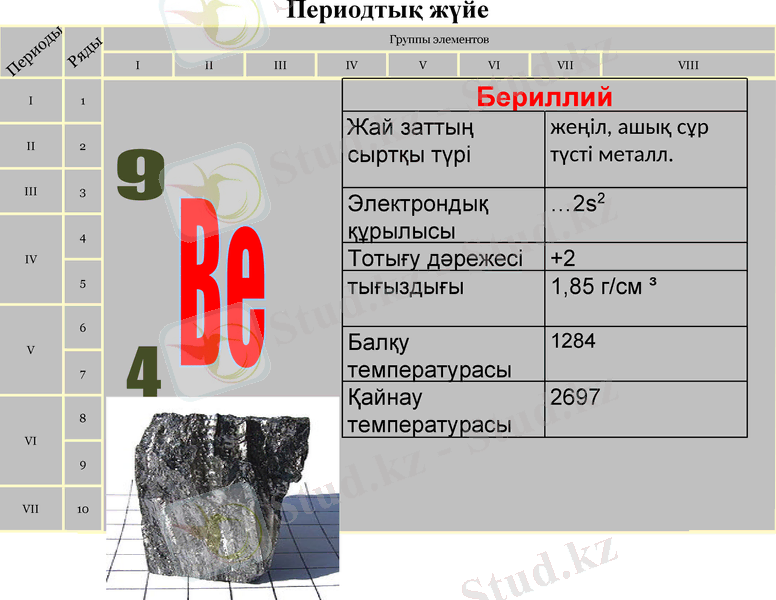
Периодтық жүйе
Группы элементов
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Be
9
4
10
Бериллий
Жай заттың сыртқы түрі
жеңіл, ашық сұр түсті металл.
Электрондық құрылысы
…2s2
Тотығу дәрежесі
+2
тығыздығы
1, 85 г/см ³
Балқу температурасы
1284
Қайнау температурасы
2697

Периодтық жүйе
Элементтердің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Mg
24
12
10
Магний
Жай заттардың сыртқы түрі
күмістей ақ, өте жеңіл, берік металл
Электрондық құрылысы
…3s2
Тотығу дәрежесі
+2
Тығыздығы
1, 74 г/см³
Балқу температурасы
651
Қайнау температурасы
1107

Периодтық жүйе
Элементтің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Cа
40, 08
20
10
Кальций
Жай заттың сыртқы түрі
Кальций ақ түсті, жеңіл
Электрондық құрылысы
…4s2
Тотығу дәрежесі
+2
Тығыздығы
1, 55 г/см ³
Балқу температурасы
840
Қайнау температурасы
1440

Периодтық жүйе
Элементтердің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Sr
87, 62
38
10
Стронций
Жай заттардың сыртқы түрі
күмістей ақ, жұмсақ металл
Электрондық формуласы
…5s2
Тотығу дәрежесі
+2
Тығыздығы
2, 63г/см³
Балқу температурасы
771
Қайнау температурасы
1384
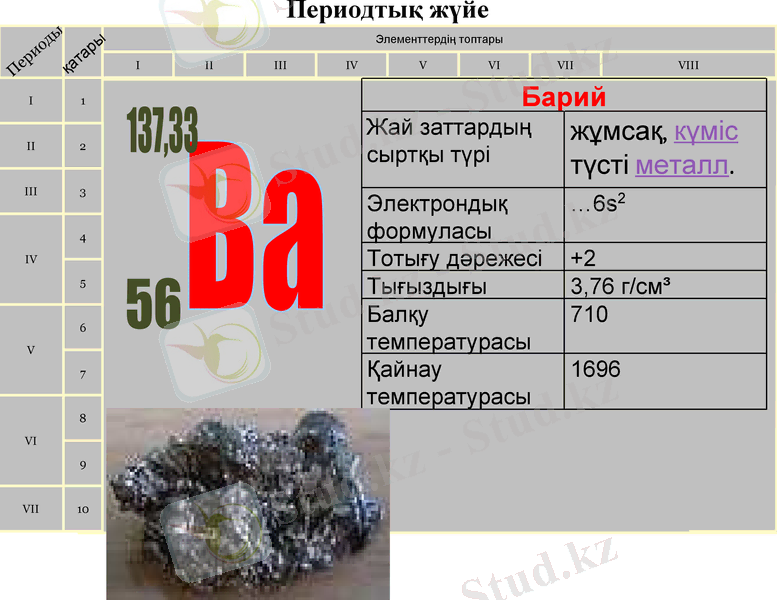
Периодтық жүйе
Элементтердің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Ba
137, 33
56
10
Барий
Жай заттардың сыртқы түрі
жұмсақ, күміс
түсті металл.
Электрондық формуласы
…6s2
Тотығу дәрежесі
+2
Тығыздығы
3, 76 г/см³
Балқу температурасы
710
Қайнау температурасы
1696

Элементтердің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Ra
226
88
10
радий
Жай заттардың сыртқы түрі
сирек
радиоактивті элемент
Электрондық формуласы
…7s2
Тотығу дәрежесі
+2
Тығыздығы
5, 5 г/см³
Балқу температурасы
973
Қайнау температурасы
2010

Бесінші орында
Массалық үлесі-3, 4%
СаСО3(бор,
мәрмәр,
әктас, маржан) .
Адам ағзасында 1кг.
Гипс CaSO4*2H2O,
аппатит Ca3(PO4) 2
Са

Сегізінші орында
Массалық
үлесі-1, 9%
Магнезит MgCO3, доломит MgCO3*CaCO3
асбест 3MgO*2H2O*2SiO2
Жасыл өсімдіктердегі хлорофилдің құрамды бөлігі.
200-ге жуық мин. құрамына кіреді.
Mg

Химиялық қасиеттері (тотықсыздандырғыштар, т. д. +2)
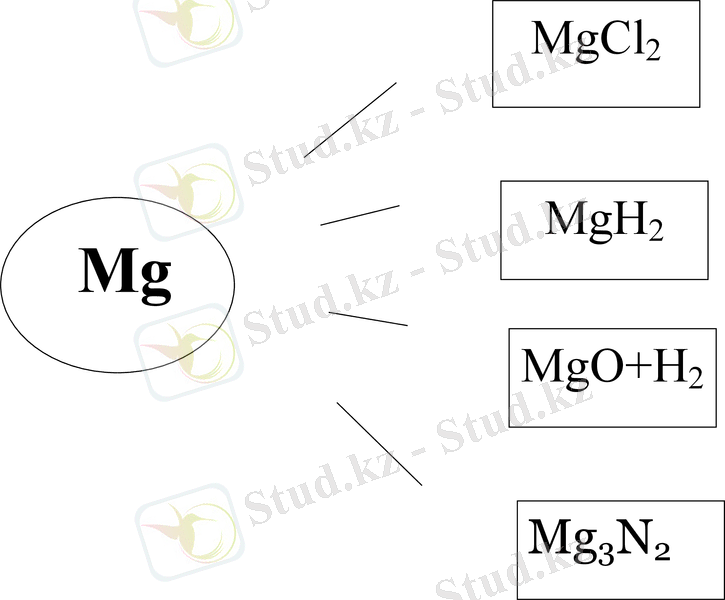
Mg
MgCl2
MgH2
MgO+H2
Mg3N2
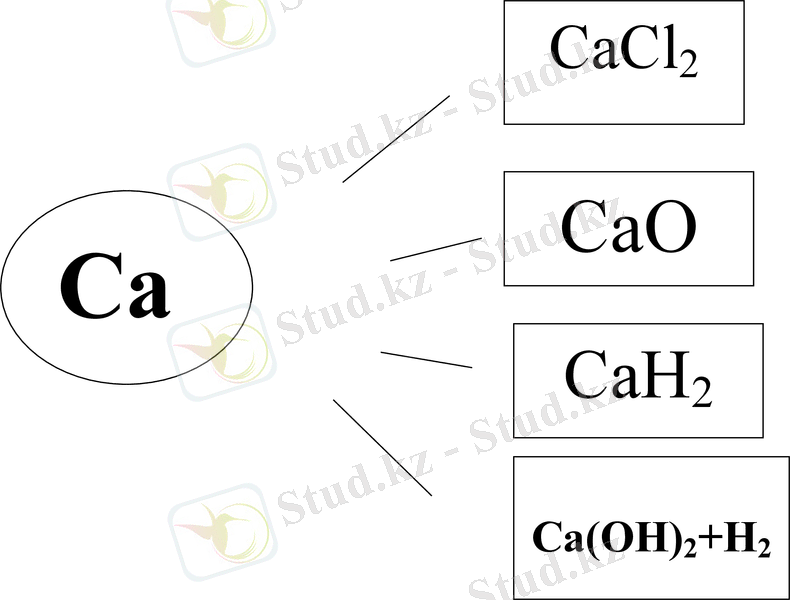
Ca
CaCl2
CaO
CaH2
Ca(OH) 2+H2

1828 жылы неміс химигі Ф. Велер
(1800-1882) берилийді алды.
Берилий элементінің ашылуы
Қолданылуы
Баяу балқитын металдардың бериллидтері - авиация
және ракета жасауда аса қажетті зат. Рентген
сәулелері бериллийден жақсы өтетін болғандықтан,
одан рентген трубкаларының терезелерін дайындайды.
Бериллий әр түрлі құймалар және коррозияға
берік болат алуда,
электротехникада, атом реакторларын жасауда
кең түрде қолданылады.
Қазақстанда бериллий Өскемендегі титан-магний
комбинатында өндіріледі.
Фридрих Вёлер

1808 ж. ағылшын ғалымы
Г. Дэви (1778 - 1829) ашқан.
Магний элементінің ашылуы
Гемфри Дэви
Қолданылуы
Магний құймаларының өнеркәсібінде, құймаларды легирлеуде, қиын тотықсызданатын және сирек металдарды металлотерм. жолмен алу үшін (мыс., Tі, Zr, Hf, U, т. б. ), магний органик. қосылыстар синтезінде қолданылады.

1808 ж. ағылшын ғалымы
Г. Дэви (1778 - 1829) алған.
Кальций элементінің ашылуы
Кальций инертті газды тазартып болат, никель, мыс,
т. б. металдарды балқыту үшін қоспа ретінде
пайдаланылады.
Кальцийдің қосылыстары құрылыста кеңінен
қолданылады.
Қолданылуы
Гемфри
Дэви

1808 ж. ағылшын ғалымы
Г. Дэви (1778 - 1829) алған.
Стронций элементінің ашылуы
Гемфри Дэви
Қолданылуы
Медицинада дәрілер даярлайды, фото,
кино ісінде, лабораториялық реактив ретінде де қолданылады.

1808 ж. ағылшын ғалымы
Гемфри Дэви (1778 - 1829) алған.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz