Галогендер мен хлор: атомдық құрылысы, кристалдық торы және химиялық қасиеттері (9-сынып)



Сабақтың тақырыбы:
Галогендер. Хлор.
9-сынып

9. 1. 4. 5. Галоген молекулаларының электрондық формулаларын құрастыру және кристалдық тор түрі мен байланыс типін анықтау;
9. 2. 1. 8. Топта галогендер қасиеттерінің өзгеру заңдылықтарын болжау;
9. 2. 1. 9. Хлордың химиялық қасиеттерін сипаттау: металдармен, сутекпен және галогенидтермен әрекеттесуі.
Оқу мақсаты:
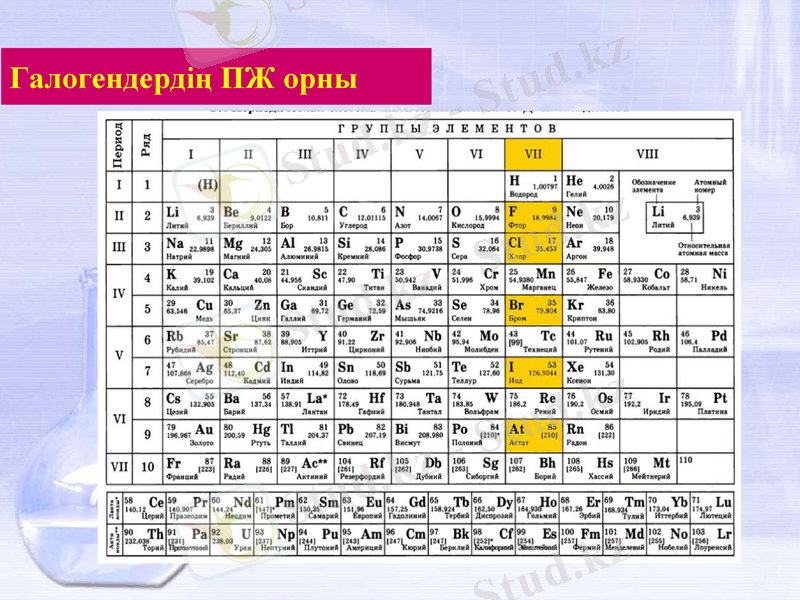
Галогендердің ПЖ орны
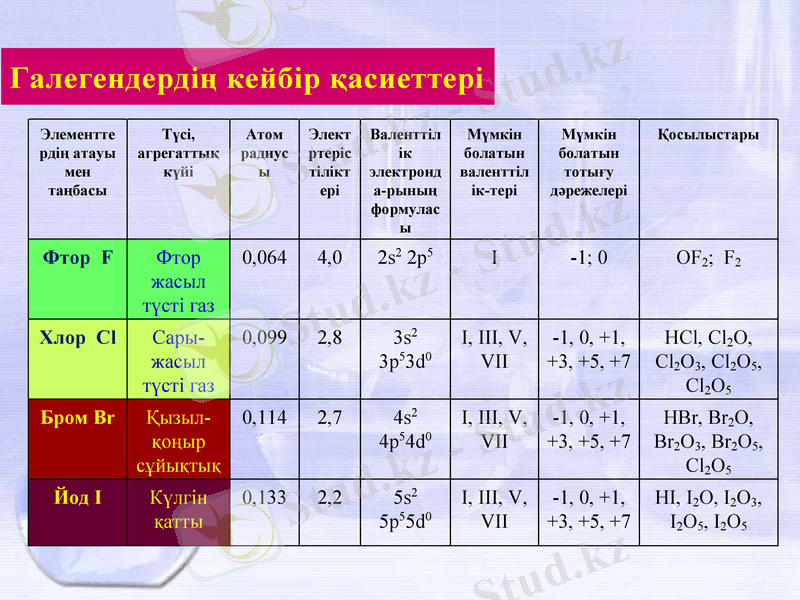
Элементтердің атауы мен таңбасы
Түсі, агрегаттық күйі
Атом радиусы
Электртерістіліктері
Валенттілік электронда-рының формуласы
Мүмкін болатын валенттілік-тері
Мүмкін болатын тотығу дәрежелері
Қосылыстары
Фтор F
Фтор жасыл түсті газ
0, 064
4, 0
2s2 2p5
І
-1; 0
OF2; F2
Хлор Cl
Сары-жасыл түсті газ
0, 099
2, 8
3s2 3p53d0
І, ІІІ, V, VII
-1, 0, +1, +3, +5, +7
HCl, Cl2O, Cl2O3, Cl2O5, Cl2O5
Бром Br
Қызыл-қоңыр сұйықтық
0, 114
2, 7
4s2 4p54d0
І, ІІІ, V, VII
-1, 0, +1, +3, +5, +7
HBr, Br2O, Br2O3, Br2O5, Cl2O5
Йод I
Күлгін қатты
0, 133
2, 2
5s2 5p55d0
І, ІІІ, V, VII
-1, 0, +1, +3, +5, +7
HI, I2O, I2O3, I2O5, I2O5
Галегендердің кейбір қасиеттері
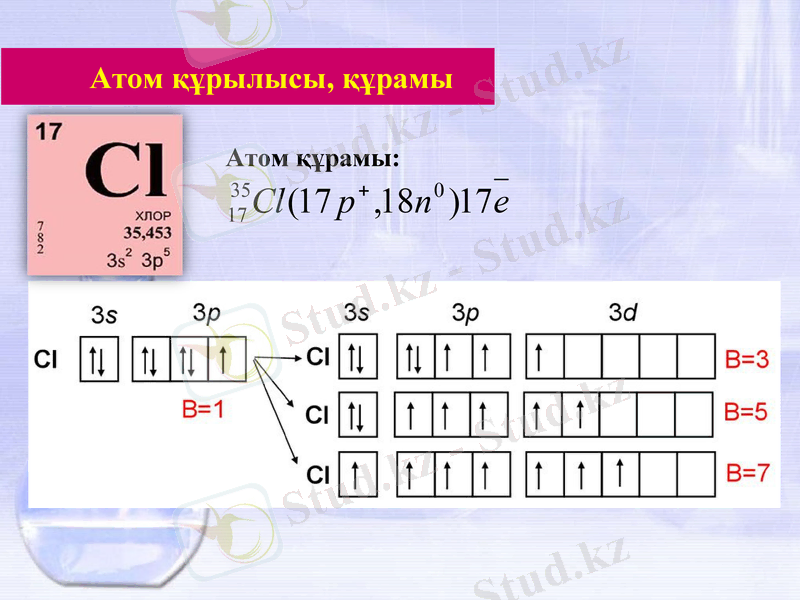
Атом құрамы:
Атом құрылысы, құрамы
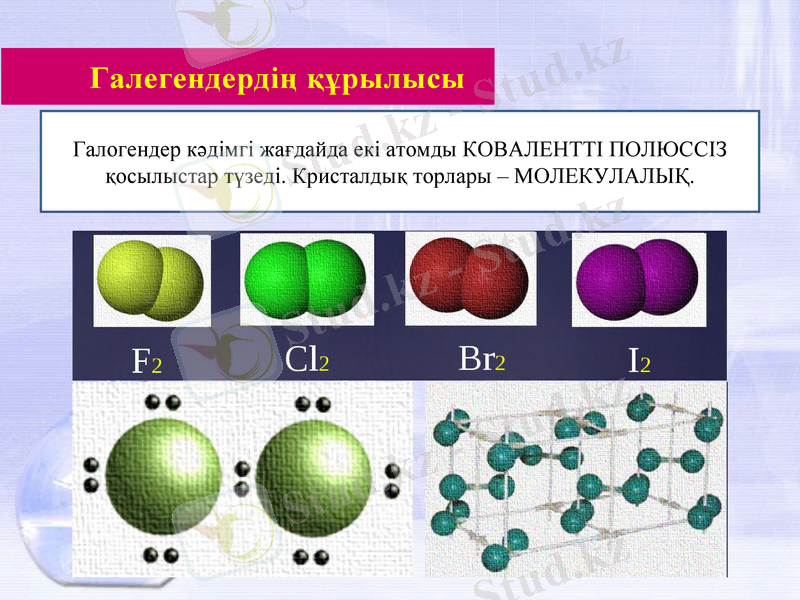
Галогендер кәдімгі жағдайда екі атомды КОВАЛЕНТТІ ПОЛЮССІЗ қосылыстар түзеді. Кристалдық торлары - МОЛЕКУЛАЛЫҚ.
Галегендердің құрылысы

Галогендер реакцияға түсу қабілеті жоғары болғандықтан қосылыстар күйінде кездеседі. Жер қыртысында таралуы фтордан йодқа қарай төмендейді. Фтор, хлор, бром және йод өндірістік масштабта өндіріледі, бірақ хлор қалғандарына қарағанда өте көп көлемде алынады.

Хлорды екі түрлі жолмен алады
Өндірісте
Зертханада
Тұз қышқылы тұздарының балқымаларын немесе ерітінділерін электролиздеу арқылы:
Осы әдіспен жұмыс істейтін зауыт Павлодарда орналсқан.
2NaCl (балқ) → 2Na + Cl2
2NaCl + H2O → H2 + Cl2 + NaOH
Тұз қышқылына әртүрлі тотықтырғыштар қосу арқылы алуға болады:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Бұл әдіспен 1774 ж К. Шееле алған
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Хлордың алынуы

Хлордың қасиеттері

Хлор қыздырылған металдармен әрекеттеседі, нәтижесінде металл хлоридтері түзіледі:
Хлордың қасиеттері

Химиялық белсенді бейметалл болғандықтан өзінен төмен орналасқан галогендерді олардың тұздарынан, қышқылдарынан ығыстыра алады.
Хлордың қасиеттері

Бекіту тапсырмалары
Галогендер молекуласындағы химиялық байланыстардың және кристалдық тордың түрлері:
Коваленттік полюстік, молекулалық
Коваленттік полюссіз, молекулалық
Металдық, металдық
Иондық, иондық
Атомдық, атомдық

Бекіту тапсырмалары
Галогендердің ішіндегі ең күшті тотықсыздандырғыш:
Фтор
Хлор
Бром
Йод
Оттегі

Бекіту тапсырмалары
Агрегаттық күйі газ болатын заттарды көрсетіңіз:
1, 3
1, 2
2, 4
2, 3
3, 4
1
Фтор
2
Хлор
3
Бром
4
Йод

Бекіту тапсырмалары
Сәкестендіріңіз:
Галогендер
Физикалық қасиеттері
1
Фтор
А
Сары-жасыл газ
2
Хлор
В
Қызыл-қоңыр сұйықтық
3
Бром
С
Қою күлгін кристалл
4
Йод
D
Ашық жасыл газ
Фтор
Хлор
Бром
Йод
А
В
С
D
Фтор - D
Хлор - A
Бром - B
Йод - C
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz