Термодинамиканың заңдары және олардың әртүрлі жүйелерге қолданылуы



Термодинамиканың заңдары, оларды әр түрлі жүйелерге пайдалану
Орындаған: Төкенова С. Е МХТ-20-1нк

Кіріспе
Термодинамика деп аталатын ғылым саласы жылу энергиясын ең аз дегенде бір энергия түріне (механикалық, электрлік және т. б. ) немесе жұмысқа ауыстыруға қабілетті жүйелермен айналысады. Термодинамиканың заңдары жылдар бойы термодинамикалық жүйе қандай да бір энергетикалық өзгерістерге ұшыраған кезде орындалатын негізгі қағидалардың бірі ретінде дамыды.

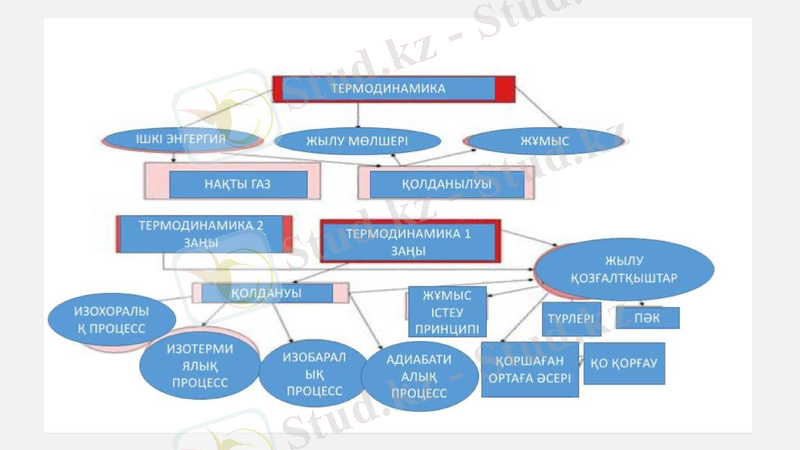
Термодинамика
Термодинамика энергияның бір түрден басқа бір түрге айналу заңдылықтарын зерттейтін ғылым.
Термодинамика жалпы (немесе физикалық), техникалық және химиялық болып үшке бөлінеді. Жалпы термодинамика термодинамика заңдарын зерттеп, солардың қатты, сұйық және газ тәрізді заттардың қасиеттеріне қолданылуын қарастырады. Техникалық термодинамикада термодинамиканың жалпы зандылықтары жылу мен жұмыстың өзара түрлену процестерін сипаттау үшін қолданылады

Химиялық термодинамика
Химиялық термодинамика мынадай негізгі мәселелерді қарастырады:
а) әр түрлі химиялық заттардың немесе бір заттың әр түрлі фазаларының тепе-теңдікте болу жағдайлары;
ә) белгілі бір жағдайда химиялық реакцияның немесе фазалар түрленуінің өздігінен жүру мүмкіндігі;
б) химиялық реакция кезіндегі жылу мен энергияның басқа түрлерінің қарым-қатынастары;
в) тепе-теңдік және химиялық реакцияның бағыты туралы мәселелерді сандық түрде көрсететін қасиеттерді өлшеу тәсілдеріне негіз болатын принциптер.

Термодинамиканың нөлінші заңы
Р. Фаулер (1931 ж. ) жылулық тепе-теңдіктің өтпелілігі туралы заң ашты: егер А және В жүйелерінің әрқайсысы С жүйесімен жылулық тепе-теңдікте болатын болса, онда А мен В жүйелері де өзара жылулық тепе-теңдікте болады.
Осы айтылған тұжырым табиғаттың негізгі заңдарының бірі болып саналады және ол термодинамиканың нөлінші заңы деп аталады.
Термодинамиканың нөлдік заңы: Үшінші жүйемен термиялық тепе-теңдіктегі екі жүйе бір-біріне жылу тепе-теңдігмені болып табылады.
Нөлдік заңның салдары - бұл температураны өлшеудің кез-келген мағынасы бар деген идея. Температураны өлшеу үшін жылу тепе-теңдігі термометрдің тұтастай алғанда, термометрдің ішіндегі сынап пен өлшенетін зат арасында жетеді. Бұл, өз кезегінде, заттың температурасы қандай екенін анықтауға мүмкіндік береді.

Термодинамиканық бірінші заңы
Термодинамиканыңң бірінші заңы табиғаттың жалпы заңдарының бірі - энергияның сақталу заңының дербес бір түрі. Оны былай тұжырымдауға болады: энергияның түрлері бір-біріне эквивалентті және бірдей қатынаста (мөлшерде) ауысады.
Егер сіз жүйеге жылу қоссаңыз, тек екі нәрсе жасалуы мүмкін - жүйенің ішкі энергиясын өзгерту немесе жүйенің жұмыс істеуіне себеп болуы (немесе, әрине, осы екі комбинация) . Барлық жылу энергиясы осы заттарды жасау керек.

Бірінші заңның математикалық көрінісі
Термодинамиканың бірінші заңы жұмыс, жылу және жүйенің ішкі энергиясының өзгеруінің арасындағы байланысты көрсетеді. Кез келген процесте жүйенің ішкі энергиясының өзгеруі ΔU=U2-U1жүйеге берілген жылу Q мен жүйе жасаған жұмыстың А айырымы тең болады:
ΔU=Q - A (1)
Егер жүйені бастапқы және соңғы күйлері бірдей болса, процестің жүру жолдарына байланыссыз ΔU -дың мәні де бірдей болады. Бұл жоғарыда айтқандай, ішкі энергия күйдің функциясы екенін көрсетеді.
Алайда жылу мен жұмыс мұндай қасиет көрсете алмайды, өйткені олар процестің жүру жолына байланысты болады және олар күйдің функциясы емес. Сондықтан өзгерістері өте аз процесс үшін теңдеуді (12) былайша жазамыз
dU=δQ - δА (2)
Мұндағы тек ішкі энергияның өте аз өзгерісі ғана дифференциалға айналады. Осы теңдеулер - (12) және (13) термодинамиканың бірінші заңының математикалың өрнектері болып табылады. Оларды XIX ғасырдың орта шенінде Д. Джоуль мен Р. Майер бір-біріне қатыссыз анықтағанын, кейінірек Г. Гельмгольц механикалық жұмыс орнына жұмыстың басқа түрін енгізіп тұжырымдағанын айта кеткен жөн.

Термодинамиканың бiрiншi заңын изопроцестерге қолдану
Изохоралық процесс.
Бұл процесте газ көлемi өзгермейдi: V = const. Газдың iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең: ΔU = Q. Егер газ қыздырылса, онда Q > 0 және ΔU > 0 - iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның iшкi энергиясы азаяды.
Изотермалық процесс.
Изотермалық процесс кезiнде газдың температурасы тұрақты болады (Т = const) және оның iшкi энергиясы өзгермейдi. Газға берiлген барлық жылу мөлшерi пайдалы жұмыс атқаруға жұмсалады: Q = А′. Газ белгiлi жылу мөлшерiн (Q > 0) алған кезде, ол оң жұмыс атқарады (А′ > 0) . Керiсiнше, егер газ қоршаған ортаға жылу берсе, онда оның атқарған жұмысы теріс болып саналады.

Изобаралық процесс. Изобаралық процесс кезiндегi газға берiлген жылу мөлшерi оның iшкi энергиясының бiрге өзгеруiне және қысым тұрақты болған кездей P = const жұмысты атқаруға шығындалады.
Адиабаталық процесс. Қоршаған ортамен жылу алмасуы болмайтын жағдайда өтетiн жүйедегi изопроцесс адиабаталық процесс деп аталады.

Тура және керi циклдар. Жылу двигателi. Карно циклi
Энергияның сақталу заңы, оның мөлшерiнiң өзгермейтiндiгiн жариялағанымен, бұнда қандай энергетикалық түрленулердiң шын мәнiнде мүмкiн болатындығын көрсетпейдi. Табиғаттағы процесстердiң барлығы тек белгiлi бiр бағытта ғана өтедi. Олар өз бетiнше керi бағытта жүзеге асырылмайды. Өз бетiнше тек бiр бағытта ғана өтетiн процестердi қайтымсыз процестер деп атайды; керi бағытта олар өздерiн тек қана күрделiрек процесстер тiзбегiнiң бiр звеносы ретiнде ғана көрсете алады

Термодинамиканың екінші заңы
Термодинамиканың бірінші заңы сияқты екінші заңының да бірнеше анықтамалары бар, олар - өзара бір-біріне эквивалентті.
Клаузиус постулаты: жылу өздігінен салқын денеден ыстық денеге өте алмайды, яғни соның нәтижесінде температурасы төменденеден температурасы жоғары денеге жылудың алмасу процесі жүзеге аспайды.
Томсон постулаты: процеске қатысатын денелердің ең салқыны (температурасы азы) жұмыс көзі бола алмайды.
Осы екі постулатты біріктіріп, мынадай тұжырым жасауға болады: цикл нәтижесінде теріс процесс ғана болуы мүмкін емес, теріс процеспен қатар оны жүргізуге себепші энергия көзі болып табылатын оң процесс те жүруі керек. Бұдан сыртқы ортаның жылуын оны тек қана салқындату арқылы жұмыстың эквиваленттік мөлшеріне айналдыратын периодтық түрде жұмыс істейтін машина болуы мүмкін емес деген қорытынды жасай аламыз

Энтропия
Клаузиус пен Томсон постулаттары дәлелденбейді, олардың дұрыстығын тәжірибелер арқылы ғана көруге болады. Өмірде оларды теріске шығаратын ешқандай жағдай болған емес. Жылу өзгерісін (δQ) былай көрсетуге аламыз:
δQ=Т·dS (3)
Мұндағы T-абсолюттік температура, dS-жаңа фyнкцияның дифференциалы, ал ол функция энтропия деп аталады.
Энтропия - тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы.

Термодинамиканың үшінші заңы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz