Химиялық байланыстың қасиеттері, молекулалық құрамы және құрылысы



Презентация
Тақырыбы: Химиялық байланыстың қасиеттері, молекула құрамы мен құрылысы.
Қазақстан Республикасының
Денсаулық Сақтау
Министрлігі
Оңтүстік
Қазақстан
Медицина
Академиясы
Биология және биохимия кафедрасы
Орындаған:Кайдаулы А
Тобы:СтКА-03-21
Қабылдаған:Дәуренбеков. Қ
Шымкент 2021 ж.

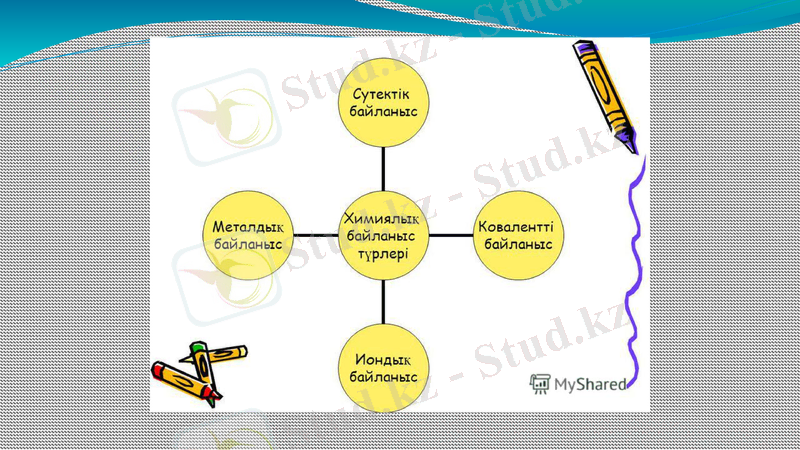
1. Химиялық байланыстың қасиеттері, молекула
құрамы мен құрылысы.
2. Коваленттік байланыс.
3. Иондық байланыс.
4. Металдық байланыс.
5. Сутектік байланыс.


Коваленттік байланыс
Коваленттік байланысқа тән қасиеттер - оның ұзындығы, энергиясы қанығуы және бағытталуы.
Байланыс ұзындығы - бұл ядролардың ара қашықтығы. Байланыс ұзындығы, неғұрлым қысқа болса, химиялық байланыс соншылықты берігірек болады. Алайда байланыстың беріктігінің өлшемі - байланыс энергиясы болады. Байланыс энергиясы байланысты үзуге қажет энергияның шамасымен анықталады. Әдетте ол 1 моль затқа шаққан кило-джоулмен өлшенеді. Тәжірбие мәліметтері бойынша Н2, Сl2 және N2 молекула байланыстарының ұзындығы 0, 074, 0, 198, 0, 109HM (нанометрге) сай келеді ал байланыс энергиясы 436, 242, 946 кДж /молье тең. Байланыстың еселігі артқан сайын байланыс энергиясы жоғарылайды, ал оның ұзындығы қысқарады. Коваленттік байланыстың бағытталуы молекулардың кеңістіктері құрылымына, яғни олардың геометриясына (пішініне) себепші болады. Мұны HC1, Н2О және NH3 молекулалардың түзілуін мысалға ала отырып қарастырамыз. Коваленттік байланыс әрекеттесуші атомдардың электрон орбитальдардың максималы қаптасқан бағытында пайда болатындығы белгілі. Қорыта айтқанда коваленттік байланыс дегеніміз - Екі атом арасында химиялық байланыс электрон жұбы ортақтасуы арқылы түзілсе, ол ковалентті байланыс деп аталады.

Коссель Вальтер
1888-1956ж. ж
Иондық байланыс теориясын 1916 жылы неміс ғалымы В. Коссель ұсынған болатын. Бұл теория типтік металдар мен типтік бейметалдар атомдары арасында:CsF, CsCl, NaCl, KF, KCl, Na2O, CaO түзілетін байланысты түсіндіреді. Осы теорияға байланысты иондық байланыстың түзілу кезінде типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды қосып алады.

Иондық байланыс
Иондық байланыстың қасиеттері. Иондық байланыстың байланыстың қасиеттерімен салыстырып қарастырамыз. Коваленттік байланыс қанымдылықты көрсетеді. Атомның түзетін коваленттік байланыстарының саны оның валенттік орбиталдарының санынан аспайды. Валенттік орбитальдар пайдаланып біткен соң, атомның коваленттік байланыс түзу мумкіншілігі қанығады. Мысалы, сутек атомының бір-ақ валентік орбиталі бар, сутек атомдары сутек молекуласына біріккенде екіатомның екеуінің де валенттік орбитальдары толық пайдаланып бітеді. Сол себеппен сутек молекуласы Н2 сутектің үшінші атомын қосып ала алмайды.
Иондық байланыс . Қарама - қарсы зарядталған иондардың кулон куштері арқылы тартылысуы нәтижесінде түзіледі. Ал кулон күштері - қанықпайтын күштер, демек, иондық байланыс қанықпаған байланыс. Егер ион зарядталған шар деп есептесек оның электр күштері ионды қоршаған кеңістіктің барлық жағына біркелкі бағытталған . Катион мен анион бірінен - бірі жақындасқанда күш өзгерістерін толық қанықтырмайды. Сол себеппенде катион да анион да, басқа бағыттар бойынша қарсы зарядталған көптеген басқа иондарды тартып, байланысқа түсе алады.


Металдық байланыс
Металдық байланыс деп электостатикалық тартылу нәтижесінде металдар иондарының және жалпыланған электрондар арасындағы түзілетін химиялық байланысты айтады.
Металдық байланыстың қасиеттері. Металл атомының электрондық құрылысына назар аударатын болсақ, сыртқы қабатындағы электрондардың саны салыстырмалы түрде көп екенін көреміз. Оның үстіне сыртқы электрондары атом ядросына әлсіз тартылатындықтан металдардың иондану энергиясы төмен болады.
Сондықтан металл атомдары бір бірімен қосылғанда сыртқы электрондары атомнанбөлініп бос электрон газын түзеді. Пайда болған металл иондары кристал тордың оң зарядты металл иондарымен берік тартылып тұрады. Металл атомдарының осылай байланысуын металдық байланыс деп атайды.
Металдық байланыс бір қарағанда ковалентті байланысқа ұқсас, екеуі де электрондар түзеді. Бірақ ковалентті байланыс тек кей атом арасында жұп электрон арқылы пайда болса, металдық байланыста ортақ электрон газы металл атомдарының бәрін бірдей берік ұстайды. Сондықтан ковалентті байланыс арқылы түзілген заттар жұмсақ, иілгіш, созылғыш болып келеді. Металлдардың барлық қасиеттері осы металдық байланыстың ерекшелігімен түсіндіріледі.

Сутектік байланыс
Сутектік байланыс деп сутек атомы мен электртрестілігі жоғары атомдар арасында болатын химиялық байланыстың түрін айтады. Сутектік байланыстың нәтижесінде заттардың қасиеттері өзгереді.
Байланыстың бұл түрінде молекулалар сутек арқылы байланысады. Байланыстың бұл түрі табиғатта өте кең тараған. Сутектік байланыс әр түрлі зат, бір түрлі зат молекула лары арасында, типті бір молекуланың болады.
Мысалы, су молекуласының құрылысын қарастырсақ, онда екі атом сутек бір атом оттекпен полюсті ковалентті байланыс арқылы байланысқан. Электрон жұптары электртерістігі жоғары элемент, оттек жаққа көбірек ығысқан. Нэтижесінде, су молекуласының сутек атомдары жағында оң заряд пайда болады.
Мұнда сутек акцептор болып табылатындықтан, судың басқа молекуласындағы оттектің артық электрон жұбын өзінің бос орбитальне қабылдау арқылы химиялық байланыс түзе алады. Сөйтіп судың бірнеше молекуласы бірімен бірі байланысып димер, тример, тетрамерлер түзеді.

Сутектік байланыс - бұл ерекше бір химиялық байланыс. Ол молекулааралық және молекулаішіндік болуы мүмкін.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz