Сольволиз және гидролиз реакциялары: тұздардың гидролизі, гидролиз константасы мен дәрежесі және дәрілік препараттарды алу мен сақтау кезіндегі рөлі



Химиялық пәндер кафедрасы Презентация Тақырыбы: Сольволиз және гидролиз реакциялары. Дәрілік препараттарды алу, сақтау кезіндегі гидролиздің рөлі.
Орындаған: Өмирбек А.
Тобы: ФӨТҚ(Б) -04-21
Қабылдаған: Серимбетова К. М.
Шымкент-2022

Жоспар
Кіріспе
Негізгі бөлім
-Тұздар гидролизі
-Гидролиз константасы және дәрежесі
-Гидролиздің биохимиялық процестердегі рөлі, оның фармациядағы маңызы
3. Қорытынды
4. Пайдаланылған әдебиеттер

Кіріспе
Гидролиз- су мен түрлі заттар арасындағы иондық алмасу реакциясы. Гидролизге тұздар, гидридтер, тиоангидридтер, галогенангидридтер, әр түрлі органикалық қосылыстар ұшырайды.
Гидролиз кейбір химиялық қосылыстардың су молекуласының әсерінен төмен молекулалы түзілімдер жиынтығына ыдырау қасиеті. Гидролиз сулы ерітінділер жағдайында немесе судың және су буының қатты, сұйық және газ тектес заттарға тигізер әсері нәтижесінде жүзеге асады.
Гидролиз- судың магма текті минералдармен негізгі химиялық реакциясы. Соның нәтижесінде сілтілік және сілтілік жер элементтерінің крисстал торындағы катиондар су молекуласы диссоциацияланғанда сутектің иондарына алмасады. Тұздардың гидролизі тұздың құрамындағы иондары мен су молекулаларының арасында жүретін, нәтижесінде әлсіз электролит молекуласы не иондары түзілетін реакциялар.

Тұздар гидролизі
Тұздардың гидролизі - тұздың құрамындағы иондары мен су молекулаларының арасында жүретін, нәтижесінде әлсіз электролит молекуласы не иондары түзілетін реакциялар. Тұздар түзілу табиғатына карай мынадай топқа бөлінеді:
Күштi негiз бен күшті қышқылдан КСІ, K2S04, NaNO3, NaCl;
Күштi негiз бен әлсіз қышқылдан Na2S, Na2C03, K2S03, Na3P04;
Әлсiз негiз бен күшті қышқылдан Al2(SO4) 3, FeSO4, ZnCl2.
Әлсiз негiзбен күшті қышқылдан түзілген тұздар гидролизденеді.
NH4CI + HOH - NH4OH + HCI қайтымды процесс. NH4+ + Cl- + HOH - NH4OH + H+ + ClNH4+ + HOH - NH4OH + H+ орта
Қышқылдық ортаның өзгеруі тұз ионының сумен әрекеттесуінің нәтижесінде пайда болады.

2. Күшті негіз бен әлсіз қышқылдан түзілген тұздар гидролизденеді
Na2CO3+HOH-NaHCO3+ NaOH
2Na+ CO32- +HOH-Na+ + HCO3- + Na+ + OH-
CO32- +HOH- HCO32- +OH- орта сілтілік
3. Әлсіз негізбен әлсіз қышқылдан түзілген тұздар гидролизденеді. Бұл жағдайда гидролиз реакциясы соңына дейін жүріп, қышқыл мен негіз түзіледі. Яғни гидролиз реакциясы қайтымсыз болады:
Al2S3 +6H2O-2Al(OH) 3+3H2S орта бейтарап.

4. Күшті қышқылмен күшті негізден түзілген тұздар гидролизге ұшырамайды. Мұндай тұздардың иондары сумен әлсіз электролиттер түзе алмайды. Тұздардың иондары іс жүзінде реакцияға қатыспайды. Судың диссоциациялану тепе-теңдігі бұзылмайды, демек ерітінді нейтрал реакция көрсетеді. Сонымен гидролизге тек құрамында әлсіз электролит қалдығы бар тұздар түседі. Сондықтан күшті негіз бен күшті қышқыл қалдығынан түзілген тұздар гидролизге түспейді. Көп негізді қышқылдар мен көп қышқылды негіздерден түзілген тұздар гидролизге сатылап түседі. Бірінші сатысы көбірек жүреді. Саты саны катион мен анионның зарядына байланысты. Гидролизді жазғанда (сатылы гидролиз үшінде) үш теңдеу жазу керек:

Гидролиздің қысқаша иондық теңдеуі;
Толық иондық теңдеуі
Молекулалық теңдеуі
Өте әлсіз қышқыл мен негіздерден тұрған тұздар гидролизі аяғына дейін жүреді:
Cr2S3+ 6HOH-2 Cr(OH) 3+ 3H2S
2Cr3+ + 3S2-+ 6 HOH-2Cr(OH) 3+ 3H2S
Гидролиз қайтымды процесс. Сондықтан әртүрлі себептердің әсері Ле Шателье принципі негізінде түсіндірілуі мүмкін: температуралардың жоғарылауы гидролиздің тез жүруіне әсер етеді, өйткені ол эндотермиялық процесс; сумен сұйылту (судың сіңірілуімен байланысқан) гидролиздің күшеюіне ықпал етеді.
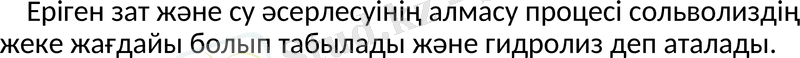
Еріген зат және су әсерлесуінің алмасу процесі сольволиздің жеке жағдайы болып табылады және гидролиз деп аталады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz