Кешенді қосылыстар: құрылысы, қасиеттері және медициналық-биологиялық маңызы



Презентация
Орындаған: Пернебеков М. Э
Тобы: В-ЖМҚА- 09-21
Қабылдаған: Профессор х. ғ. к: Алиханова Х. Б
«Химиялық пәндер кафедрасы»
Тақырыбы: Кешенді қосылыстар және олардың қасиеттері. Кешенді қосылыстардың медициналық-биологиялық маңызы.

Жоспар:
Кіріспе
Негізгі бөлім
2. 1. Кешенді қосылыстардың құрылысы. Кешенді қосылыстардың
номенклатурасы мен түрлері.
2. 2. Кешенді қосылыстардағы химиялық байланыс.
2. 3. Кешенді қосылыстардың диссоциациясы мен ерітінділердегі тепе-
теңдік.
2. 4. Кешенді қосылыстардың биологиялық маңызы, медицина мен
фармацияда қолданылуы. Гемоглобин және темірқұрамдас фермент
Қорытынды
Пайдплынған әдебиеттер
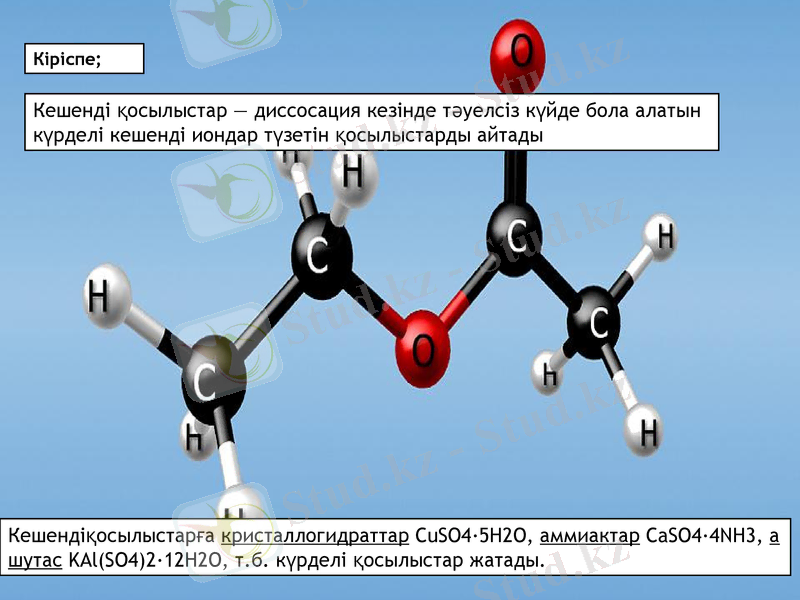
Кіріспе;
Кешенді қосылыстар - диссосация кезінде тәуелсіз күйде бола алатын күрделі кешенді иондар түзетін қосылыстарды айтады
Кешендіқосылыстарға кристаллогидраттар CuSO4·5H2O, аммиактар CaSO4·4NH3, ашутас KAl(SO4) 2·12H2O, т. б. күрделі қосылыстар жатады.

Кешенді қосылыстар қазіргі кезде көзқарас бойынша:
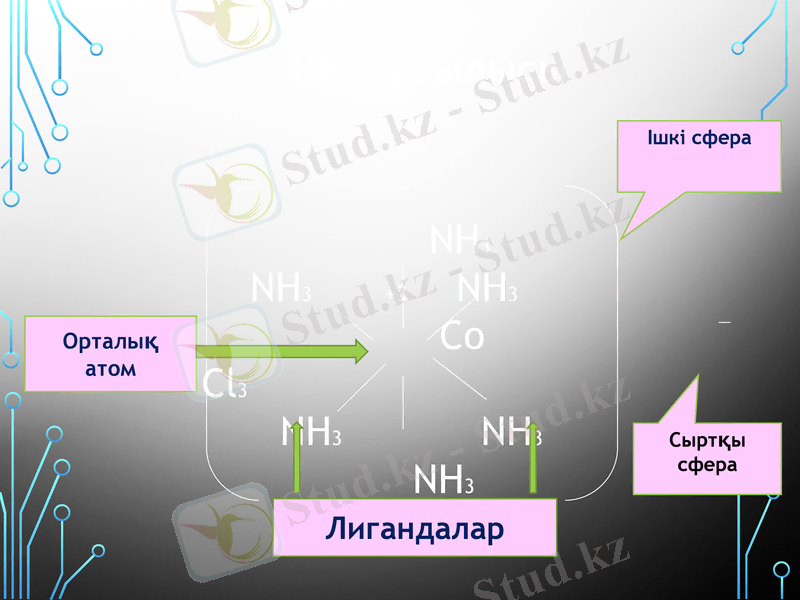
Ішкі кординациялық сфера дегеніміз кешен ионның (бөліктің) өзі ол кешен түзуші - орталық атомнан және оның маңайында орналасқан лиганд топтарынан (олар молекула не ион болуы мүмкін H2O, NH3, Cl, Br, F, J, CN, т. б) тұрады
Орталық атомды қоршаған лигандалар саны координациялық сан деп аталады. Көптеген жағдайда координациялық сан орталық атомның ион заряды екі еселегенге тең. Мысылы; Cu координациялық саны 4- ке тең орталық атом - Co коордтнациялық саны 6-ға тең бірақ, бұл кейбір жағдайдаларда орындалмайды.

Na[Al(OH) 4]
NaOH
Al(OH) 3
Комплексті қосылыстар, немесе жай комплекстер, деп біз комплексті иондарды және комплексті молекулаларды атаймыз.
3KCN + Fe(CN) 3 = K3[Fe(CN) 6]
4NH3 + CuSO4 = [Cu(NH3) 4] SO4
Комплексті қосылыстар дегеніміз құрамында бір немесе бірнеше донорлы- акцепторлы байланыс болатын жоғары ретті қосылыстарды айтамыз.

КҚ номенклатурасы
1962 жылы химиктердің Халықаралық Одағы (ІUPAC) ұсынған номенклатурасы қолданылады.
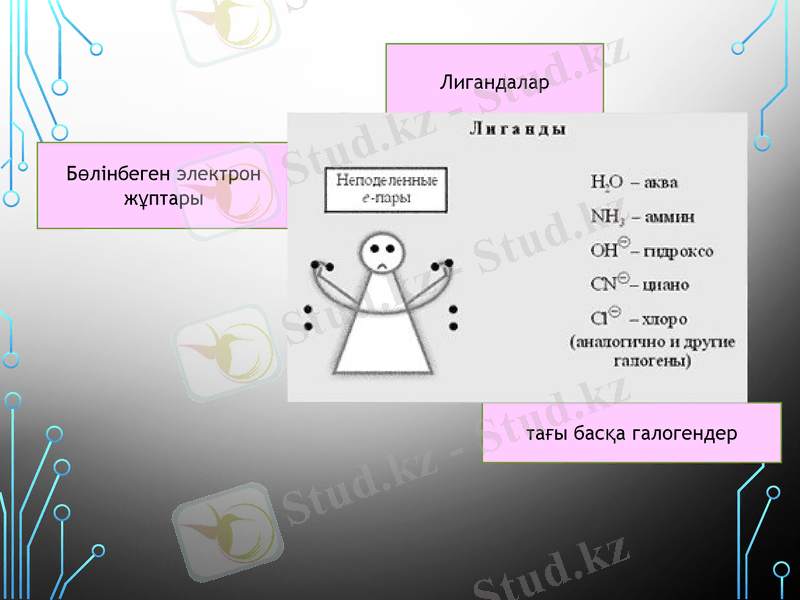
Теріс зарядты лигандтардың атауына «О» деген жалғау жалғанады СI- хлоро-, СN- циано-.
Электробейтарап лигандтар былай аталады:
H2O-аква NH3-аммин CO-карбонил NO-нитрозил
OH-гидроксо O-окси т. б.
Комплекс құрамындағы лигандтардың саны грек сан есімдерімен белгіленеді:
ди (екі), три (үш), тетра(төрт), пента (бес), гекса (алты) т. б.


Кешенді қосылыстар құрылысы және қасиеттерін 1893 жылы швейцария ғалымы, Нобель сыйлығының лауреаты А. Вернер ұсынған координациялық теория түсіндіреді
Координациялық теорияның негізгі қағидалары
1) Комплексті қосылыстарда оң зарядты ортада орналасқан атомның (металл) комплекс түзушінің -орны зор. Комплекс түзуші (орталық катион) - ваканттық е -орбитальдары бар металл катионы.
Катиондар:
металдар (d-элементтер) :
Сu+2, Co+3, Fe+3, Hg+2 және т. б.
(р-элементтер сирек) : Al+3
(бейметалдар кейде) : В+3, Si+4.
2. Комплекс түзушінің айналасында бөлінбеген электрон жұптары бар теріс зарядты иондар немесе бейтарап молекулалар - лигандалар орналасады.
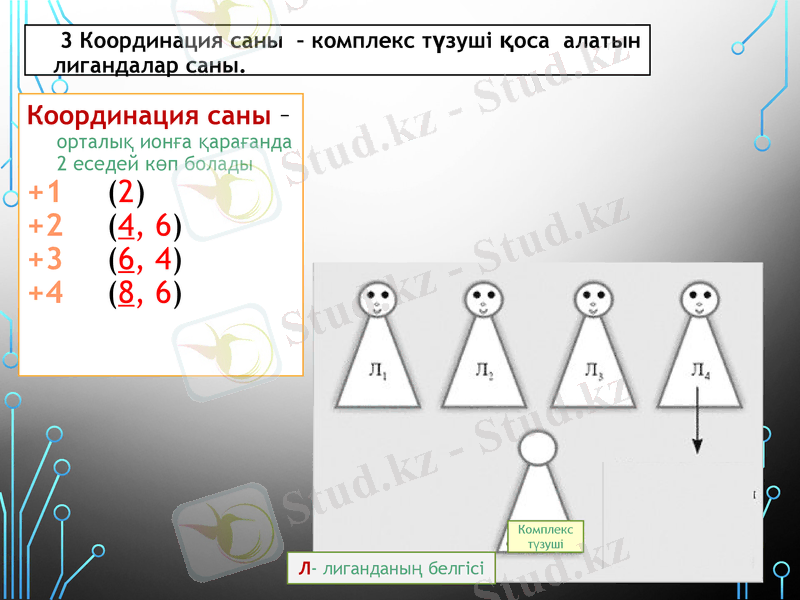
3 Координация саны - комплекс түзуші қоса алатын лигандалар саны.
Координация саны - орталық ионға қарағанда 2 еседей көп болады
+1 (2)
+2 (4, 6)
+3 (6, 4)
+4 (8, 6)
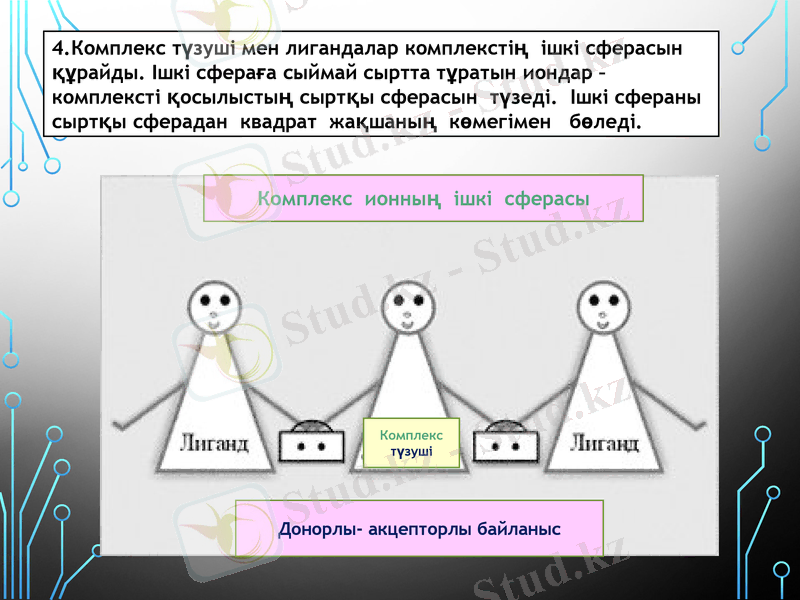
4. Комплекс түзуші мен лигандалар комплекстің ішкі сферасын құрайды. Ішкі сфераға сыймай сыртта тұратын иондар - комплексті қосылыстың сыртқы сферасын түзеді. Ішкі сфераны сыртқы сферадан квадрат жақшаның көмегімен бөледі.

Қазіргі кезде комплекс қосылыстарындағы химиялық байланысты мына үш түрлі теория түсіндіреді:
валенттік байланыс әдісі;
кристалл өрісі теориясы;
молекулалық орбитальдар әдісі.
Бұл теориялар комплекс қосылыстарының құрылысын, қасиетін түсіндіруде бір-бірін толықтырып тұрады.
Валенттік байланыс (ВБ) әдісі негізінде жұп ортақ электрондар көмегімен және көбінесе донорлық- акцепторлық механизм арқылы комплекс иондар түзілетіні алынады.
Осы әдіс көмегімен көптеген комплекс қосылыстарының түзілуі, олардың магниттік қасиеттері, координациялық санның мәні жақсы түсіндіріледі. Осы әдіс арқылы комплекс қосылыстарға түсінікті анықтама берілген.

Кешенді қосылыстың диссосациясы екі сатыдан өтеді ;
1 ші сатыда электролит катион және анионға ыдырайды, оның біреуі кешенді ион болып табылады.
2 ші сатыда кешен ионы әлсіз электролит сияқты диссиоциацияланады
Келтірілген комплекс иондарының диссоциациялану константаларын тұрақсыздық константасы Кт. з. деп атайды. Тұрақсыздық константаларының сандық мәндері комплексті иондардың тұрақтылығын немесе беріктігін көрсетеді. Кт. з. пайдаланып, комплексті қосылыстың арасындағы реакция қай бағытта жүретінін анықтауға болады.
[Ag(NH3) 2] + ↔ Ag+ + 2NH3
[Ag(CN) 2] - ↔ Ag+ + 2CN-
Кт. з. = ([Ag+] ∙[NH3] 2) /[Ag(NH3) 2] + =6, 8∙10-8
Кт. з. = ([Ag+] ∙[CN-] 2) /[Ag(CN) 2] - =1, 0∙10-21
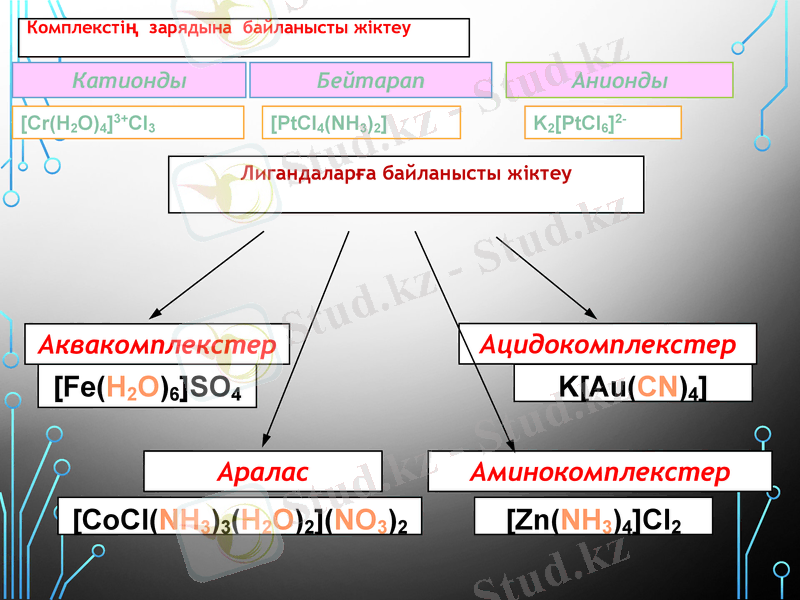
Комплекстің зарядына байланысты жіктеу
Катионды
Бейтарап
[Cr(H2O) 4] 3+Cl3
[PtCl4(NH3) 2]
Анионды
K2[PtCl6] 2-
Лигандаларға байланысты жіктеу

Комплексті қосылыстардың маңызы
Халық шаруашылығында қолданады: оларды Pt металдарын, Au, Ag, Cu, Ni, Co алуға және тазалауға пайдаланылады. Сирек кездесетін металдарды бөлуге аналитикалық химияда сапалық, сандық анализдерге қолданады.
Металдарды коррозиядан қорғауға қолданады. Металдарға жабысқақ қасиеті бар тұрақты және ерімейтін комплексті қосылыстар коррозия процесін баяулатады немесе мүлдем тоқтатады.
Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде үлкен роль атқарады. Адамдар мен жануарлар қанының құрамындағы гемоглобин тыныс алу процесін қамтамасыз етеді.
Гемоглобин - комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу дәрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді.

Комплекс түзуші элементтерді “тіршілікті ұйымдастырушылар” деп атайды. Соңғы кезде Pt-ң және Pd-дың комплексті қосылыстарын қатерлі ауруларды емдеуге пайдалануға болады.
Хелатты комплексті қосылыстарды бүйректегі тастарды ерітуге және судың кермектігін жоюға қолданылады. Комплексті қосылыстарды клиникаларда дәрі-дәрмек ретінде қолданып, әр түрлі ауруларды емдеуді хелатты терапия деп атайды.
Трилон Б көптеген металл иондарымен комплексті қосылыстар түзеді. Сондықтан ағзада кальций тұздары бөліне жүретін ауруларды емдеуге пайдаланылады.
НООС-СН2 CH2COOH
N-CH2-CH2-N немесе Na2H2Tr
NaООС-СН2 CH2COONa
Кобальттың комплексті қышқылдары ақуыз алмасуының активтілігін жоғарылатады, бұлшықет ақуыздарының синтезін тездетеді.
Мырыштың комплекс қосылысы диабетке қарсы препарат-инсулин болып келеді.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz