Дәріс 5. Ферменттер: құрылымы мен биохимиялық маңызы



Дәріс 5. Ферменттер. Ферменттердің құрылымы. Биохимиялық маңызы

Жоспары:
Фермент туралы жалпы түсінік
Ферменттердің химиялық құрамы және құрылымы
Ферменттер атаулары мен классификациясы
Ферменттер әсерінің теориясы
Ферменттік реакциялардың кинетикасы
Ферменттер қасиеттері
Иммобилденген ферменттер
Ферменттердің практикалық маңызы
Ферменттер (лат. fermentum -
ашу; грек тілінде - enzym, еn-
ішкі, zyme - ашытқы) тірі
ағзада түрлі биохимиялық
реакцияларды белсендіруші,
биологиялық катализатор.

Ферменттерді және олар катализдейтін реакцияларды зерттейтін биохимия бөлімі энзимология деп аталады.
ХІХ ғасырдың ортасында кейбір фермент препараттары (уыттан - амилаза, қарын сөлінен пепсин, т. б. ) бөлініп алынды.
Ең алғаш таза ферментті 1926 ж. жас биохимик Дж. Самнер кристалл түрінде алды.
Зерттеліп табылған ферменттердің саны 6000-ға жуық. Олардың бәрі де белокты заттар.
Ферменттердің бәрі де үлкен молекулалы қосылыстар, олардың молекулалық массасы 10мыңнан 1млн-ға жетеді.

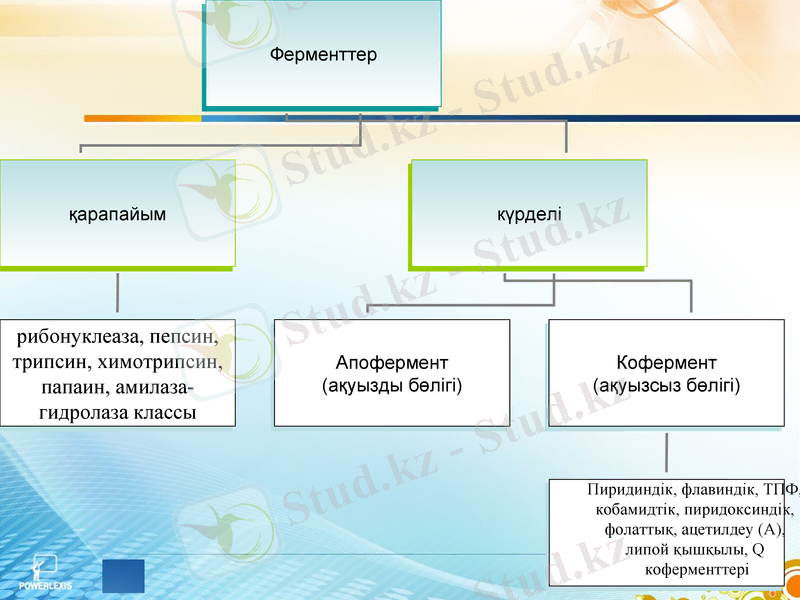
Ферменттің құрылысы
Апофермент - ақуыз денесі (белоктық бөлігі)
Каталитикалық орталық
Субстраттық орталық
Ақуыздың активті бөлігі
Аллостериялық (реттегіш) орталық
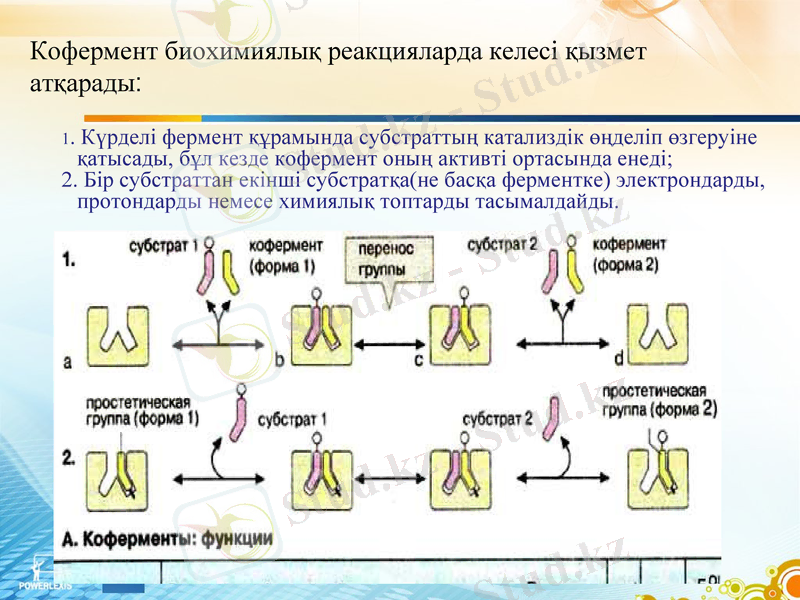
1. Күрделі фермент құрамында субстраттың катализдік өңделіп өзгеруіне қатысады, бұл кезде кофермент оның активті ортасында енеді;
2. Бір субстраттан екінші субстратқа(не басқа ферментке) электрондарды, протондарды немесе химиялық топтарды тасымалдайды.
Кофермент биохимиялық реакцияларда келесі қызмет атқарады:

Ферменттің активті орталығы
Фермент молекуласының субстратпен тікелей тиісіп жанасатын бөлігін ферменттің активті орталығы деп аталады;
Активті орталық бүйір радикалында функционалды тобы бар амин қышқылдарының қалдықтарынан түзіледі.
Күрделі ферменттерде активті орталыққа металл иондары мен коферменттер де кіреді.

Реакцияласуға қабілетті топтары бар амин қышқылдары:
цистеин, құрамында сульфгидрлік тобы -SH бар;
серин, гидроксильдік -OH тобы бар;
гистидин, имидазол сақинасы бар;
аспарагин мен глутамин қышқылдары құрамында екінші карбоксильдік -COOH топ бар;
триптофан, құрамында индол сақинасы;
гидрофобты амин қышқылдары, құрамында субстраттың полярсыз учаскесіне жақын гидрофобты (полярсыз) бүйір топтар болады.
Активті орталық кеңістік пішінді, ол ферменттің полипептидтік тізбегінде бірінен-бірі қашық орналасқан жеке амин қышқылдарының өзара жақындасуынан пайда болады.

Аллостериялық орталық
Екі немесе одан да көп суббөліктен тұратын бірқатар ферменттерде, өзінің катализдік орталығынан тыс, молекула бетінде қосымша байланыстырушы учаске болады, ол учаске аллостериялық орталық деп аталады. Мұндай ферменттер аллостериялық ферменттер деп аталады.
“Аллостериялық” (грек. Allo - басқа, stereos - орын) деген термин “басқа жермен байланысты” не “басқа орталықпен байланысты” деген мағынаны береді.
Ферменттердің аллостериялық эффекторлары: субстраттар немесе реакция өнімдері, нуклеотидтер (АМФ, АТФ), амин қышқылдары, металл иондары, сутегі иондары.

Ферменттер атаулары
Жүйелік атау: әр ферменттің номері (шифры) болады, ол төрт саннан тұрады.
бірінші сан ферменттің класын білдіреді,
екінші сан класс тармағын,
үшінші сан - класс тармағы бөлігін,
төртінші сан өз тармағындағы номерін көрсетеді. Мысалы, 2. 7. 1. 2. АТФ: глюкоза-6-фосфотрансфераза.
Тривиалдық атаулар екі жолмен пайда болады:
1) Фермент әсер ететін субстрат атауына -аза жұрнағы қосылады. Мысалы, мальтозаны екі молекула глюкозаға гидролиздейтін фермент мальтаза.
2) Фермент катализдейтін реакция атауына -аза жұрнағы қосылады (оксидаредуктаза) .
Кейбір ферменттердің тарихи қалыптасқан атаулары бар. Мысалы, пепсин, трипсин, папаин, эластаза, т. б.
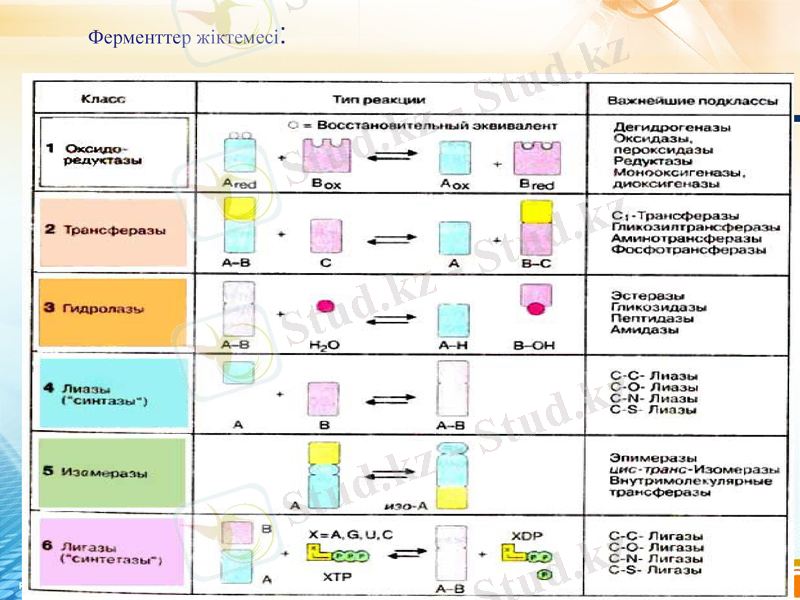
Ферменттер жіктемесі:
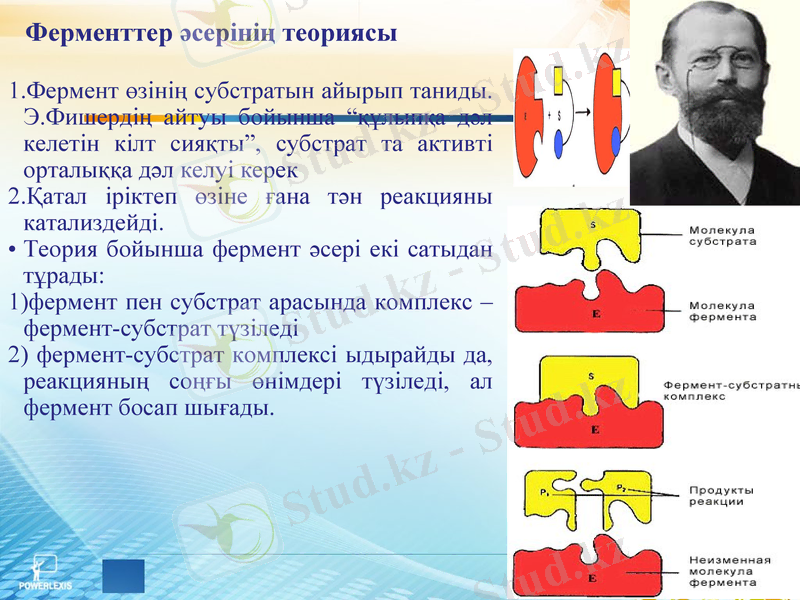
Ферменттер әсерінің теориясы
Фермент өзінің субстратын айырып таниды. Э. Фишердің айтуы бойынша “құлыпқа дәл келетін кілт сияқты”, субстрат та активті орталыққа дәл келуі керек
Қатал іріктеп өзіне ғана тән реакцияны катализдейді.
Теория бойынша фермент әсері екі сатыдан тұрады:
1) фермент пен субстрат арасында комплекс - фермент-субстрат түзіледі
2) фермент-субстрат комплексі ыдырайды да, реакцияның соңғы өнімдері түзіледі, ал фермент босап шығады.

Ферменттік реакциялар кинетикасы
Ферменттік реакциялар кинетикасы деп реакция жүру жылдамдығын айтады.
Реакция жылдамдығын белгілі бір уақыт өлшемінде фермент әсерімен түзілген өнім бойынша (немесе субстраттың жойылу мөлшері бойынша) есептейді.
Л. Михаэлис пен М. Ментен бойынша: фермент концентрациясы тұрақты кезде реакция жылдамдығы субстрат концентрациясына байланысты.
Реакция жылдамдығы субстрат концентрациясына пропорционал болмайды.

Ферменттердің қасиеттері
Ферменттік реакциялар жылдамдығына температураның әсері;
Ортаның рН көрсеткішінің әсері;
Фермент әсерінің ерекшелігі;
Фермент активаторлары мен ингибиторлары;
Проферменттер және оларды активтендіру;
Изоферменттер;
Мультиферменттік жүйе.

Фермент активтілігіне температура әсері
30-400С температурады тірі ағзада ферменттер белсенді келеді. Егер бұл температура деңгейі төмен не жоғары болса, онда фермент белсенділігі төмендейді
Ферменттің өзі ақуыз болғандықтан, олар өте жоғары температурада бұзылып, өздерінің катализдік қасиеттерінен айырылып қалуы мүмкін.
Төменгі температурада ферменттік реакциялардың жылдамдығы өте төмен болады. Бұл жағдай практикада азық-түлік өнімдерін сақтау үшін (ет, май, балық, сүт, көкөністер т. б. ) пайдаланады.
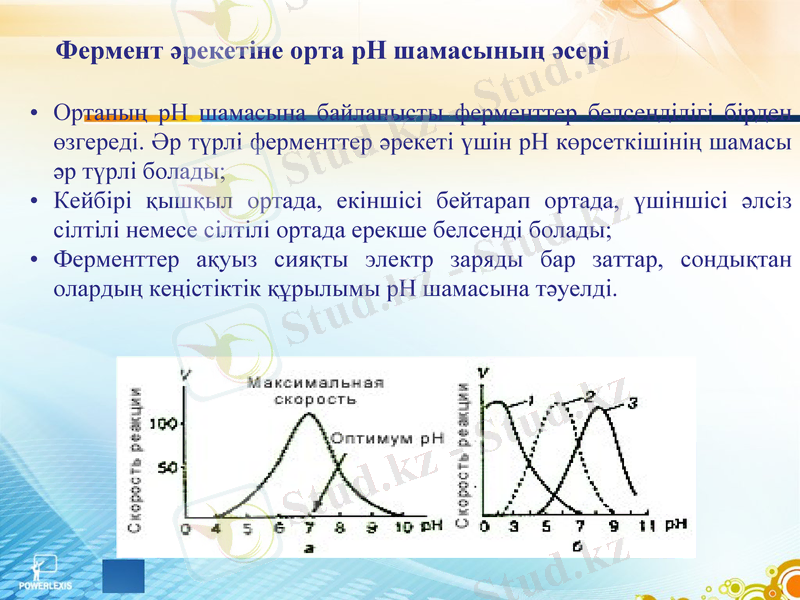
Фермент әрекетіне орта рН шамасының әсері
Ортаның рН шамасына байланысты ферменттер белсенділігі бірден өзгереді. Әр түрлі ферменттер әрекеті үшін рН көрсеткішінің шамасы әр түрлі болады;
Кейбірі қышқыл ортада, екіншісі бейтарап ортада, үшіншісі әлсіз сілтілі немесе сілтілі ортада ерекше белсенді болады;
Ферменттер ақуыз сияқты электр заряды бар заттар, сондықтан олардың кеңістіктік құрылымы рН шамасына тәуелді.
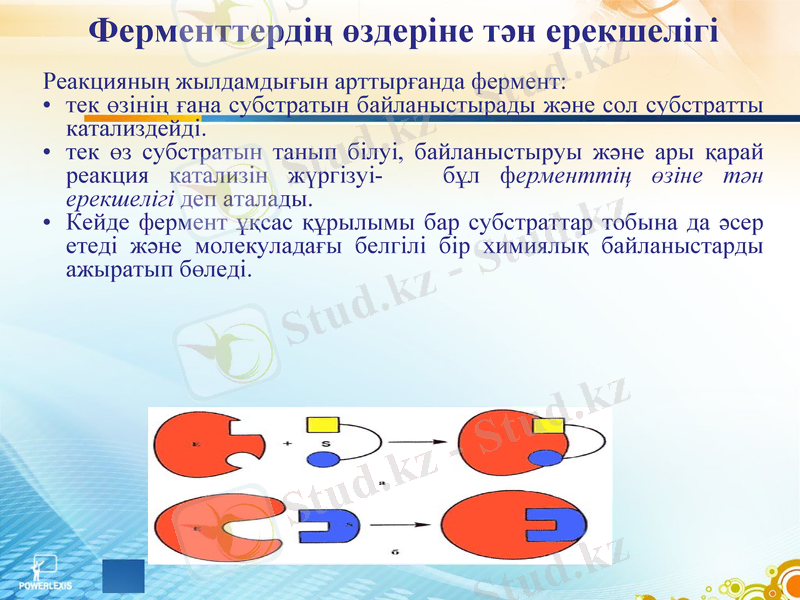
Ферменттердің өздеріне тән ерекшелігі
Реакцияның жылдамдығын арттырғанда фермент:
тек өзінің ғана субстратын байланыстырады және сол субстратты катализдейді.
тек өз субстратын танып білуі, байланыстыруы және ары қарай реакция катализін жүргізуі- бұл ферменттің өзіне тән ерекшелігі деп аталады.
Кейде фермент ұқсас құрылымы бар субстраттар тобына да әсер етеді және молекуладағы белгілі бір химиялық байланыстарды ажыратып бөледі.

Ингибиторлар мен активаторлар
- Фермент активтілігі ортада әр түрлі химиялық заттардың болуына байланысты. Кейбір зат фермент активтілігін арттырады, мұндай қосылыстар активаторлар деп аталады.
- екінші бір заттар фермент әрекетін баяулатады, тіпті оны тежейді. Мұндай заттар ингибиторлар (тежегіштер) деп аталады.
- ферменттер әсерінің бәсекелес және бәсекелес емес тежеушісін ажыратып бөледі.

Проферменттер мен изоферменттер
Проферменттер(лат. pro - алдыңғы, бұрынғы және фермент деген сөзден шыққан) - ферменттердің активті емес түрі. Безді эпителийде бірқатар протеолиттік ферменттер белсенді емес күйде - проферменттер (зимогендер) түрінде синтезделеді. Осының арқасында проферменттер түзілген жасушалар мен тканьдер өздерін өздері бүлдіріп бұзбайды.
Проферменттердің белсенді түрге (ферментке) айналуын физиологиялық және биохимиялық жағдайлар реттейді. Проферменттің белсендіру үдерісі жүреді:
пептидтік байланысты үзу арқылы профермент молекуласынан бір немесе бірнеше пептид бөлініп ажырайды, осының нәтижесінде ферменттің сәйкес конформациясы қалыптасады және оның белсенді бөлігі ашылады.

Изоферменттер (грек. isos - тең, бірдей және фермент деген сөзден шыққан) - бір ферменттің әр түрі, олардың полипептидтік құрылысында бір-бірінен өзгешелігі болады. Олар бір түрге жататын ағзада немесе жеке жасушада кездеседі, олардың катализдік активтілігі әр түрлі болады.
Адам ағзасының әр түрлі тканьдерінде лактатдегидрогенның 5 изотүрі табылды (ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5)
Жануарлар, өсімдіктер және микроағзалардың жеке бастарының шыққан тегін анықтау үшін белгілі бір изоферменттің бар екені немесе жоқ болуы генетикалық белгі болып табылады.

Мультиферменттік жүйе
Бұл көптеген әр түрлі ферменттерден құралған комплекс.
Әрбір жеке мультиферменттік жүйе 2 ферменттен 20 ферментке дейінгі топтан құралады.
Мультиферменттік жүйеде бірінші фермент катализдеген реакция өнімі екінші фермент катализдейтін келесі реакция үшін субстрат болады, т. с. с.

Ферменттердің практикалық маңызы
Бактериалдық ашу
Физиологиялық реттегіш
Катализ
Жасушалық метаболизм
Макромолекулалар
Генетикалық аппарат
Тамақтану
Мембраналар ультрақұрылысы
Коферменттер
Фармокология
Биосинтез
Реакциялар кинетикасы
Энергия айналуы
Биохимиялық эволюция
Тума зат алмасу бұзылуы

Иммобилденген ферменттер
Иммобилденген (лат. immobilis - қозғалмайтын)
ферменттер - қатты таянышқа (полимерге, целлюлозаға, әйнекке) бекіген ферменттер.
Ондай ферменттер ерімейтін материалмен ковалентті байланысады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz