Химиялық кинетика: реакция жылдамдығы, молекулалық ерекшеліктері және температура мен катализдің әсері



“ “Астана Медицина Университеті” АҚ Жалпы және биологиялық химия кафедрасы
Тақырыбы: Химиялық кинетика
Қабылдаған:Базарханқызы Айдана
Орындаған : Арапбай Жансәуле
Тобы: ЖМ - 115
Астана, 2018

ЖОСПАР:
Кіріспе
Негізгі бөлім
Химиялық реакциялардың жылдамдығы
Химиялық реакциялар жылдамдығының температураға тәуелділігі
Химиялық реакциялар жылдамдығының катализаторлардың қатысуына тәуелділігі.
Химиялық реакциялардың молекулалығы мен реті
Қорытынды
Пайдаланылған әдебиеттер

Химиялық кинетика
Химиялық кинетика - химиялық реакцияның жылдамдығын, реакцияның жүру механизмін және оған әртүрлі факторлардың әсерін зерттейтін ғылым саласы
Бастапқы заттар
Реакция өнімдері

Химиялық реакциялардың жылдамдығы
белгілі бір уақытта әрекеттесетін заттар мөлшерінің өзгеруін айтады
Uорташа = ±

Химиялық реакция жылдамдығына әсер ететін факторлар:
температура
қысым
катализатор
реакцияға қатысқан заттардың табиғаты
еріткіштің табиғаты
реагенттердің концентрациясы

Реакцияға қатысатын заттардың табиғатына байланысты
Гомогендік- әрекеттесетін және түзілетін заттар бірдей агрегаттық күйде болса
Гетерогендік- әрекеттесетін және түзілетін заттар әртүрлі агрегаттық күйде болса

Әрекеттесуші заттардың концентрациясы химиялық реакция жылдамдығына қалай әсер етеді?
Химиялық реакциялар тез жүруі үшін түйісетін молекулалар саны көп болуы керек, яғни концентрацияны өсіру керек. Реакцияның жылдамдығына әрекеттесуші заттардың концентрацияларының әсерін зерттеген Норвегияның екі ғалымы Гульдберг және Вааге 1867 жылы мынадай қорытындыға келген: химиялық реакцияның жылдамдығы реакцияласушы заттардың концентрацияларының көбейтіндісіне тура пропорционал болады, оны әрекеттесуші массалар заңы деп атайды.
Жалпы А + В = С теңдеуі бойынша жүретін реакциялар үшін бұл заң мынадай теңдеумен өрнектеледі. :
ν = k САСВ
Мұндағы СА және СВ - А және В заттарының концентрациясы, моль/л, k - жылдамдық константасы деп аталатын пропорционалдық коэффицент.

Химиялық реакциялар жылдамдығының температураға тәуелділігі
Температура жоғарлаған сайын химиялық реакцияның жылдамдығы артады. Гомогендік реакциялар жылдамдығының температураның жоғарлауына байланысты артуын 1884 жылы ашылған Вант- Гофф ережесі анықтайды:“Tемператураны 10° өсіргенде реакцияның жылдамдығы 2-4 есе артады”
υТ2 = υТ1 γТ2 - Т1/10,
мұндағы
γ - температуралық коэффициент
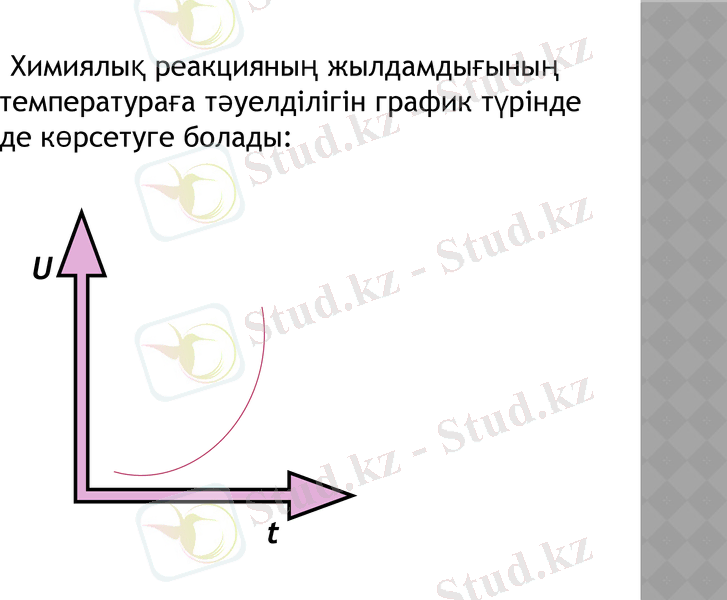
Химиялық реакцияның жылдамдығының температураға тәуелділігін график түрінде де көрсетуге болады:
U
t
g

Химиялық реакцияның жылдамдығының температурасы өсуіне сәйкес жоғарлауын 1889 жылы ашылған С. Аррениус теориясы дәлірек көрсетеді:
К= А• е - E a¢ /RT
К- жылдамдық константасы, А- соқтығысулардың жалпы саны
E a¢- активтену энергиясы, е- натурал логарифмнің негізі

С. Аррениус теориясы бойынша молекулалардың әрекеттесуі, олардың соқтығысқан кездегі энергия қорына байланысты, яғни реакцияға тек бойында артық мөлшерде энергия қоры бар молекулалар ғана қатыса алады да мұндай молекулар активтелген молекулар деп атайды. Орташа энергия қоры бар молекуланы реакцияға қатыса алатындай актив күйге келтіру үшін жұмсалатын энергияны активтендіру энергиясы дейді.
Химиялық реакцияның жүру температурасы өскенде химиялық әрекеттесуге әкеліп соғатын “активті молекулалардың” да саны артады.

Химиялық реакциялар жылдамдығының катализатордың қатысуына тәуелділігі
Катализатор деп, реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын заттарды атайды.
Егер катализатор реакция жылдамдығын арттыратын болса, оны оң, ал баяулататын болса теріс катализатор деп атайды.
Егер катализатор реакция барысында түзілсе, оны автокатализ деп атайды.
Кейбір заттар катализатордың әсер етуіне кедергі жасайды, ондай заттарды ингибиторлар немесе катализатор улары дейді.
Ал кейбір заттар өздері катализатор болмаса да, катализатордың активтілігін арттырады, ондай заттарды активаторлар дейді

Қышқылды - негіздік катализ
Қышқылды - негіздік катализ- қышқылдың реакцияға қатысатын заттың біріне өзінің протонын беруі арқылы жүретін катализдің түрі. Оның мысалы ретінде күрделі эфирлердің гидролизін көрсетуге болады.
Күрделі эфирлер гидролизденгенде Ингольстің теориясы бойынша мына сатылардан өтеді:

Бұл мысал қышқылдың катализаторлық үлесін көрсетеді:
1) Күрделі эфирге қышқыл өз протонын береді де өзі ионға айналады
2) Протонды қосып алу арқылы түзілген оксоний-ион тұрақсыз келеді де, одан әрі ыдырауға ұырайды, нәтижесінде карбакатион және спирт түзіледі
3) Әрі қарай карбакатион су молекуласымен әрекеттеседі
4) Соңғы түзілген оксоний-ион, реакцияның бірінші сатысында түзілген негізбен әректтеседі де, қышқыл реакциядан босап шығады

Химиялық реакциялардың реті
Реакциялардың реттілігі деп жалпы түрде экспериментальды жолмен табылған кинетикалық теңдеулердегі реагент концентрациясының дәрежелік көрсеткішінің қосындысын айтады.
Мысалы:
n 1А + n 2В = n3 С + n4Д
реакциясы үшін реакцияның реті
n = n1 + n2

Күрделі реакциялар
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz