Молекулалардың геометриялық құрылысы: электрон жұптарының тебісу теориясы (ОЭПВО), Р. Гиллеспидің әдісі және шектеулері



Қожа Ахмет Ясауи атындағы халықаралық қазақ-түрік университеті
Жаратылыстану факультеті Экология және химия кафедрасы
Тақырыбы:Молекуланың геометриялық құрылысы. Электрон жұптарының тебісу теориясы
Қабылдаған:
Орындаған: Абдувахитова Шарбан

Жоспар:
І. Кіріспе
ІІ. Негізгі бөлім
Электрон жұптарының тебісу теориясының сипаттамасы және тарихы
Электрон жұптарының тебісу әдісі (Р. Гиллеспи әдісі)
ІІІ. Қорытынды
ОЭПВО теориясының кемшіліктері және оның болжамдарынан ауытқуы

Валенттік орбитальдардың электронды жұптарының тебу теориясы (ОЭВПО) - молекулалардың геометриясын түсіндіру және болжау үшін қажетті химиядағы тәсілдердің бірі болып табылады. Бұл теорияға сәйкес, молекула әрқашан сыртқы электрон жұптарының тебілуі минималды болатын формада болады (ең аз энергия принципі) .
1940 жылы Н. Сиджвик пен Г. Пауэлл электрон жұбының тебілуінің үлгісін ұсынды, оны кейіннен Р. Гиллеспи мен Р. Найхолм әзірледі (1957) .

Өтпелі емес элементтер қосылыстарына ғана қолданылатын бұл тәсілдің негізгі идеялары:
1. Көп валентті атомның (немесе ионның) байланыс конфигурациясы тек орталық атомның валенттік қабатындағы байланысатын және байланыспайтын электрон жұптарының санымен анықталады.
2. Валенттік орбитальдардың электронды жұптары бұлттарының бағыты оларды толтыратын электрондардың өзара максималды тебілуімен анықталады.
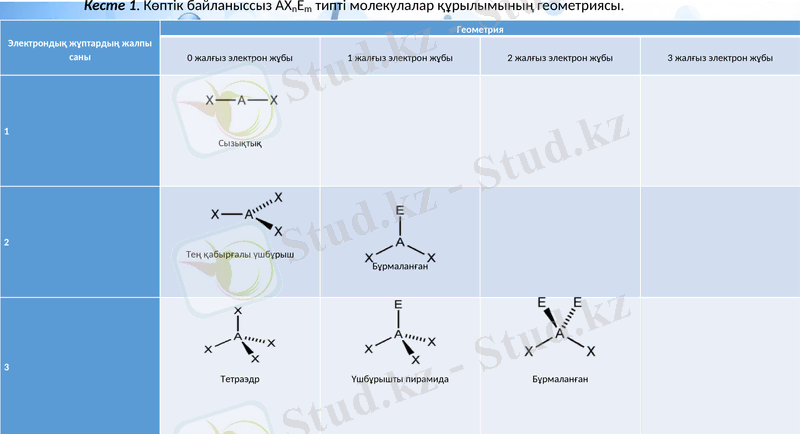
Электрондық жұптардың жалпы саны
Геометрия
0 жалғыз электрон жұбы
1 жалғыз электрон жұбы
2 жалғыз электрон жұбы
3 жалғыз электрон жұбы
1
Сызықтық
2
Тең қабырғалы үшбұрыш
Бұрмаланған
3
Тетраэдр
Үшбұрышты пирамида
Бұрмаланған
Кесте 1. Көптік байланыссыз AXnEm типті молекулалар құрылымының геометриясы.
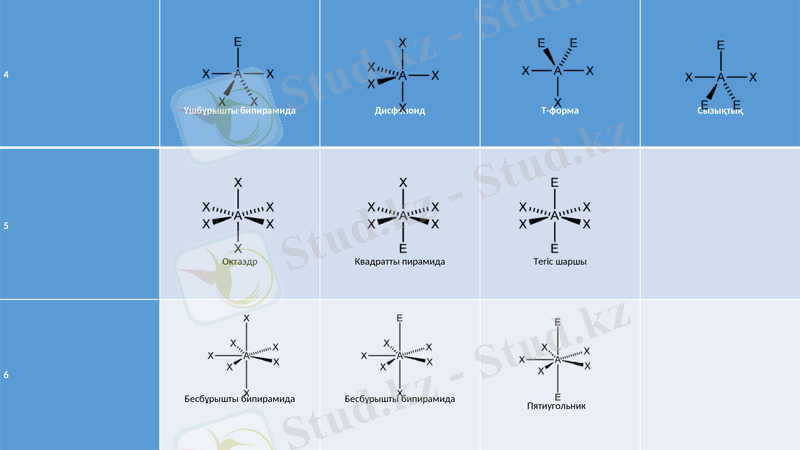
4
Үшбұрышты бипирамида
Дисфеноид
Т-форма
Сызықтық
5
Октаэдр
Квадратты пирамида
Тегіс шаршы
6
Бесбұрышты бипирамида
Бесбұрышты бипирамида
Пятиугольник
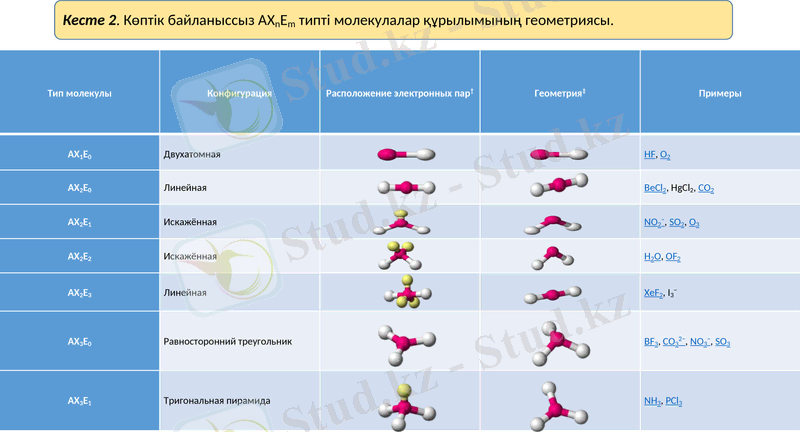
Тип молекулы
Конфигурация
Расположение электронных пар†
Геометрия‡
Примеры
AX1E0
Двухатомная
HF, O2
AX2E0
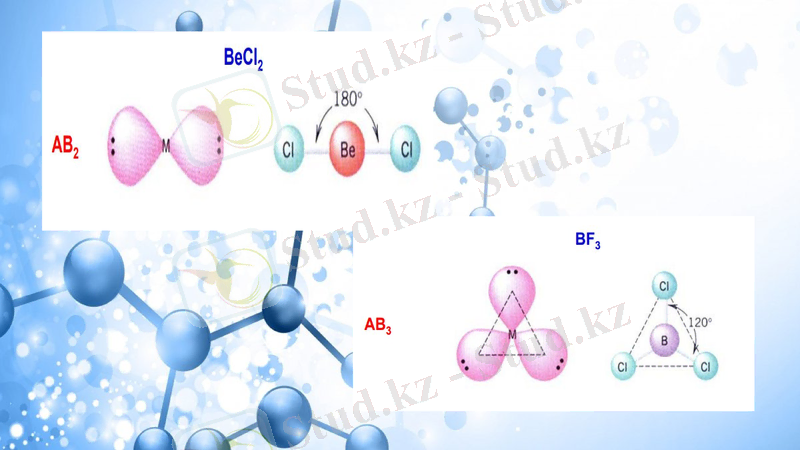
Линейная
BeCl2, HgCl2, CO2
AX2E1
Искажённая
NO2−, SO2, O3
AX2E2
Искажённая
H2O, OF2
AX2E3
Линейная
XeF2, I3−
AX3E0
Равносторонний треугольник
BF3, CO32−, NO3−, SO3
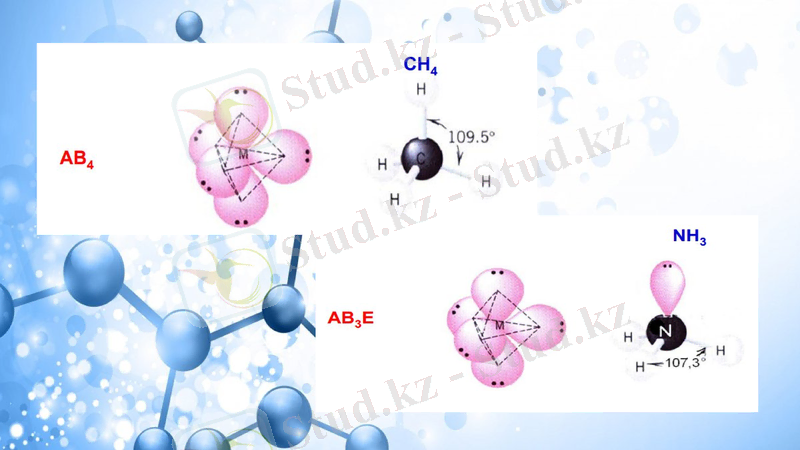
AX3E1
Тригональная пирамида
NH3, PCl3
Кесте 2. Көптік байланыссыз AXnEm типті молекулалар құрылымының геометриясы.

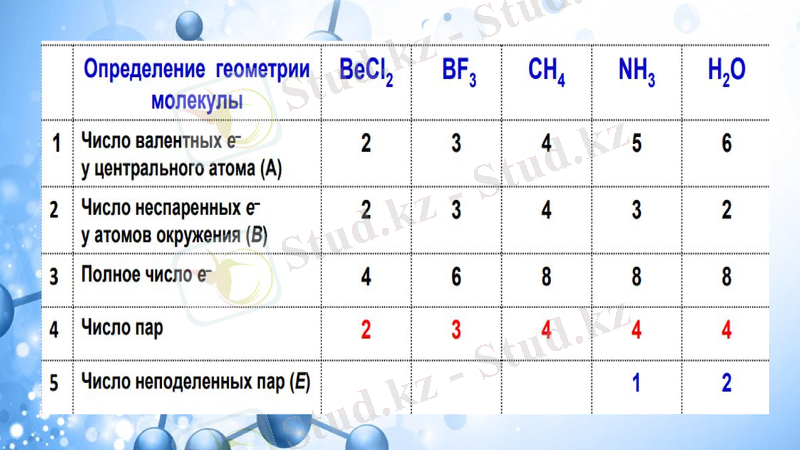
Электрон жұптарының тебісу әдісі (Р. Гиллеспи әдісі)
1-ереже: Орталық атомды қоршап тұрған электрон жұптары бір-бірінен максималды қашықтықта орналасатындай кеңістікте орналасады.
2-ереже: Бөлінбеген электрондар жұбы ортақ электрондар жұбына қарағанда кеңістікте көбірек көлемді алады.
3-ереже: Молекулаларда көп байланыстардың болуы молекулалардың геометриясына әсер етпейді.


Қорытынды
ОЭПВО теориясының кемшіліктері және оның болжамдарынан ауытқуы
- Алдыңғы бөлімдерде атап өтілгендей, теория тек өтпелі емес элементтердің, яғни толық толтырылмаған ішкі электронды қабаттары жоқ элементтердің молекулаларының құрылымын сипаттауға қолданылады. Мәселе мынада, мұндай қабықшалардың болуы, мысалы, өтпелі элементтер атомдарында d-электрондар ядролық электрондардың таралуының сфералық симметриясынан ауытқуға әкеледі. Бұл, өз кезегінде, орталық атомға қатысты кеңістікте электрон жұптарының бұлттарының таралуы (1) қатынасқа дәл бағынбауына әкеледі. Бұл ауытқулар, әсіресе, өтпелі элементтердің d-қабаттарындағы электрондардың айтарлықтай санымен (6-9) байқалады.
- Төменгі периодтардың элементтері түзетін байланыстарға d-орбитальдардың қатысуы да ОЭПВО теориясының тұжырымдамалары негізінде күтілетін геометриядан ауытқуға әкеледі. Белгілі мысал - сілтілі жер галогендік молекулаларының бұрыштық бұрмалануы.
- Иондық типке жақын жоғары полярлы байланыстары бар қосылыстар үшін ОЭПВО теориясының болжамдарымен үлкен сәйкессіздіктер байқалады. Сонымен, АХ2Е2 типіне жататын Li2O молекуласы бұрыштық емес, сызықтық пішінге ие. Соңғысы электростатикалық тұрғыдан түсінікті, егер Li2O Li+02-Li+ иондық құрылым түрінде ұсынылған болса.

- АХ6Е типті және басқа орталық атомның координациялық саны жоғары қосылыстарда бөлінбеген электрондар жұбы стереохимиялық инертті және құрылымы E электронды жұбын есепке алмай алынған конфигурацияға сәйкес келеді. Осылайша, аниондар SbCl63-, ТеСl62- октаэдрлік құрылымға ие, дегенмен олар ксенон гексафториді ХеF6 сияқты валенттік қабатта жеті электронды жұптан тұрады. Алайда, ХеF6, ОЭПВО теориясына сәйкес, дұрыс емес октаэдрдің құрылымына ие (3-кесте), ал бұл аниондарда барлық байланыстар эквивалентті. Басқа мысал Сs2[XeF8] 2-. Орталық атом тоғыз электрон жұбымен қоршалған бұл тұздың анионы, теорияның күткеніне қайшы, төртбұрышты антипризмнің құрылымына ие. Белгіленген ауытқулардың себебі, валенттік электрон жұптарының бірі, атап айтқанда ns2 күшті локализацияланған және өзінің қасиеттері бойынша басқа электрон жұптарының сипаттамаларынан күрт ерекшеленеді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz