Электролиттік диссоциация: электролиттер мен бейэлектролиттердің классификациясы, диссоциация теориялары, диссоциация дәрежесі және рН



Электролиттік диссоциация

Электролиттер және бейэлектролиттер
Тұздар
Қышқылдар
Сілтілер
Бейметалдар жай заттар
Органикалық суда еритін заттар (қышқылдардан, аминдерден, тұздардан басқа)

Су ерітіндісінде немесе балқымада электр тогын жүргізу қабілетіне сәйкес барлық заттарды электролиттер мен электролиттерге бөлуге болады.
Электролиттер-бұл су ерітінділері немесе балқымалары электр тогын өткізетін заттар.
Бейэлектролиттер-бұл су ерітінділері немесе балқымалары электр тогын өткізбейтін заттар.
Бейэлектролиттерге, мысалы, оттегі, сутегі, көптеген органикалық заттар жатады.
Бұл заттардың молекулаларында ковалентті полярлы емес немесе азполярлы байланыс бар.

Ерітінділердің екі теориясы
"Ерітінділер-еріткіш пен еріген зат арасында әрекет ететін күштермен анықталатын химиялық қосылыстар»
Д. И. Менделеев
Химиялық теория

Ерітінділердің екі теориясы
С. Аррениус
"Ерітінділердегі электролиттер ішінара диссоциацияланған молекулалардан тұрады, олардың саны ерітінді сұйылтылған кезде артады; Молекулалардың диссоциациясы кезінде пайда болған иондар электролит ерітінділерінің нақты физикалық және химиялық қасиеттерін анықтайды; Шексіз сұйылтылған ерітінділерде молекулалар тек иондар түрінде болады; Ерітіндідегі зат неғұрлым белсенді болса, соғұрлым ол иондарға ыдырайды".
Электролиттік диссоциация теориясы
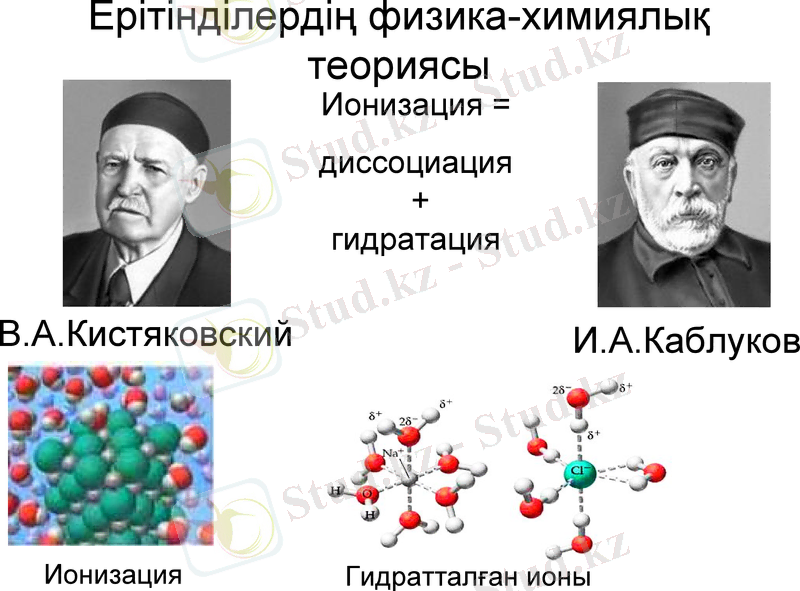
Ерітінділердің физика-химиялық теориясы
И. А. Каблуков
Ионизация =
диссоциация + гидратация
Гидратталған ионы
В. А. Кистяковский
Ионизация

Электролиттік диссоциацияның негізгі ережелері
Электролит молекулалары суда еріген немесе еріген кезде иондарға ыдырайды. Иондар-оң немесе теріс заряды бар атомдар немесе атомдар тобы.
Иондар болуы мүмкін
Жай (Na+, Mg2+, S2-, Cl- ) :
Күрделі (SO32-, NH4+, SO42-, PO43-) .
Электролит молекулаларының сулы ерітіндіде немесе балқымада иондарға ыдырау процесі электролиттік диссоциация немесе ионизация деп аталады
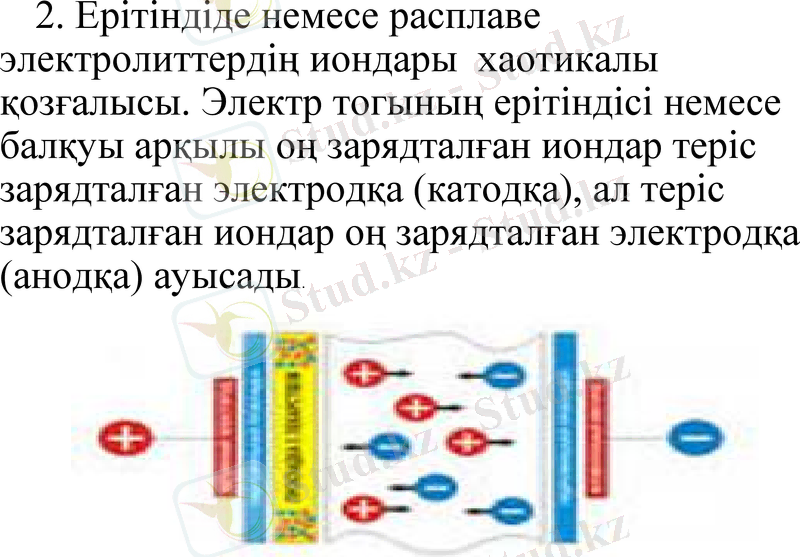
2. Ерітіндіде немесе расплаве электролиттердің иондары хаотикалы қозғалысы. Электр тогының ерітіндісі немесе балқуы арқылы оң зарядталған иондар теріс зарядталған электродқа (катодқа), ал теріс зарядталған иондар оң зарядталған электродқа (анодқа) ауысады.
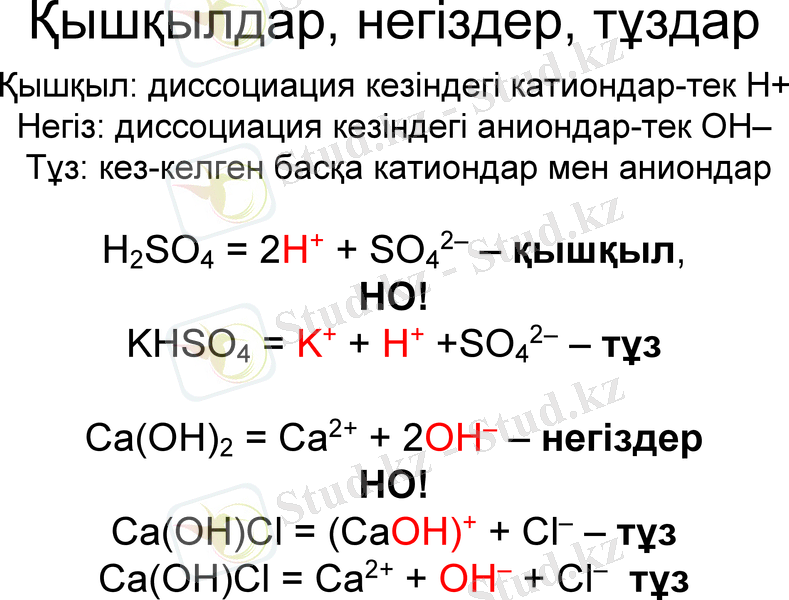
Қышқылдар, негіздер, тұздар
Қышқыл: диссоциация кезіндегі катиондар-тек H+ Негіз: диссоциация кезіндегі аниондар-тек OH-
Тұз: кез-келген басқа катиондар мен аниондар
H2SO4 = 2H+ + SO42- қышқыл,
НО!
KHSO4 = K+ + H+ +SO42- тұз
Ca(OH) 2 = Ca2+ + 2OH- негіздер
НО!
Ca(OH) Cl = (CaOH) + + Cl- тұз
Ca(OH) Cl = Ca2+ + OH- + Cl- тұз

Күшті электролиттер
Толығымен немесе толығымен ыдырайды
Класс
Мысалдар
Тұздар
Практически все
Негіздер
Бейорганикалық: ia және IIA (Be(OH) 2, Mg(OH) 2 топтарындағы металдардың гидроксидтері) ; Be (OH) 2-амф.
Қышқылдар
Бейорганикалық: HClO4, HClO3, HCl, HBr, HI, HNO3, HMnO4, H2SO4, H2Cr2O7 (күшті дибаз қышқылдарының сирек мысалдары!), барлық күрделі иондық қышқылдар (H[BF4], H[SbF6], H[AuCl4] және т. б. ) Органикалық: rso3h сульфоқышқылдары, roso3h алкил сульфаттары

Сулы ерітінділерде кейбір электролиттер иондарға толығымен ыдырайды. Басқа электролиттер ішінара иондарға бөлінеді.
Олардың молекулаларының көпшілігі ерітіндіде бөлінбеген күйде қалады. Мұндай электролиттердің ерітінділерінде иондар мен бөлінбеген ерітінді молекулалары бір уақытта болады.
Диссоциацияланған және бөлінбеген электролит молекулаларының арақатынасын сандық сипаттау үшін ұғым қолданылады
"электролиттік диссоциация дәрежесі".
Диссоциация дәрежесі "α" әрпімен белгіленеді және көбінесе пайызбен, көбінесе бірлік фракцияларында көрсетіледі.

Электролиттік диссоциация дәрежесі иондарға ыдыраған молекулалар санының ерітілген электролит молекулаларының жалпы санына қатынасына тең:
мұндағы n-иондарға ыдырайтын молекулалар саны; N-ерітілген молекулалардың жалпы саны.

ЕРІТКІШ ТАБИҒАТЫ МЕН ЕРІТІНДІНІҢ ТАБИҒАТЫНАН.
Бір еріткіштегі бірдей зат электролит сияқты, ал басқаларында электролит емес сияқты әрекет ете алады. .
H2SO4 күкірт қышқылының молекулалары суда жақсы ыдырайды, этанолда әлсіз және бензолда мүлдем ыдырамайды. Себебі су ең полярлы еріткіштердің бірі, этанол аз полярлы, ал бензол полярлы емес еріткіш болып табылады.
.
неге байланысты?
Еріткіш табиғаты (полярлы және т. б. )
- Н2О > C2H5OH > (C2H5) O > C6H6
HCl сусыз эфирде Na әсер етпейді!
Электролит табиғаты
- Иондық байланыс - күшті электролиттер
- Полярлы ковалентті - күшті және әлсіз
- Полярсыз ковалентті - бейэлектролиттер

Температураның жоғарылауымен молекулалардың энергиясы артады, олардағы химиялық байланыс әлсірейді, бұл электролиттердің диссоциациялану процесін, яғни олардың иондарға ыдырауын жеңілдетеді.
Керісінше, температураның төмендеуі электролиттің иондану дәрежесін төмендетеді.
2. ТЕМПЕРАТУРАДАН
- кәдімгі ΔНдисс > 0 ⇒ температура өскенде α↑

3. АТТАС ИОНДАРДЫҢ БОЛУЫ - α↓ - Ле Шателье принципі
Диссоциация дәрежесіне әлсіз электролит ерітіндісіне бірдей иондардың қосылуы әсер етеді.
Мысалы, егер сірке қышқылының ерітіндісіне CH3COONA натрий ацетаты ерітіндісі қосылса, онда сірке қышқылының қайтымды диссоциация процесінің тепе-теңдігі
СН3СООН СН3СОО-+ Н + Ле-Шателье принципіне сәйкес солға жылжиды. Сондықтан сірке қышқылының диссоциациялану дәрежесі төмендейді.

Сұйылту заңын шығару
HAn ⇄ H+ + An-
С0 СHAn 0 0
ΔC -x x x
Сравн СHAn - x x x
Т. к. , то:
Т. к. , то:

Оствальд сұйылту Заңы
К. В. Оствальд
Тек әлсіз электролиттердің өте сұйылтылған ерітінділері үшін!
α ∼ 1/√CKtAn
С → 0 ⇒ α → 1
HCl-10 есе сұйылту кезінде [H+] 10 есе төмендейді CH3COOH-10 рет сұйылтылған кезде [H+] тек ∼ 3, 1 есе төмендейді!
Өте сұйылтылған ерітінділерде тіпті әлсіз электролиттер толығымен ыдырайды!
4. ОТ КОНЦЕНТРАЦИИ
- Әлсіз электролиттер үшін - С↑ ⇒ α↓

диссоциация константа
HAn ⇄ H+ + An-
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz