Гесс заңы және химиялық реакциялардың жылу эффектілерін есептеу әдістері



Гесс заңы және оның салдары
Оқыту мақсаты:
10. 3. 1. 4 Гесс заңының физикалық мағынасын түсіну және оны химиялық реакциялардың жылу эффектілерін есептеп шығаруда қолдануға үйрену
Сабақ мақсаты:
Гесс заңы бойынша анықтамалық мәліметтерді пайдаланып химиялық реакцияның жылу эффектісін есептейді
Бағалау критерийі:
Гесс заңы бойынша анықтамалық мәліметтерді пайдаланып химиялық реакцияның жылу эффектісін есептей алады
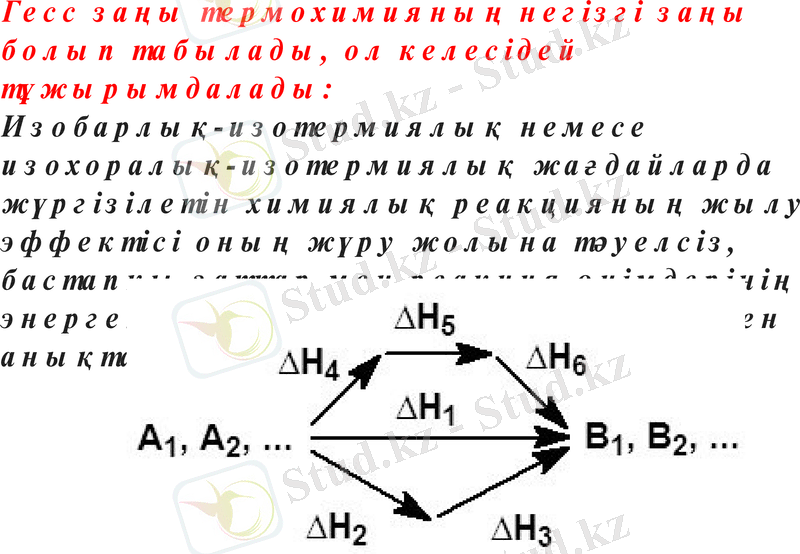
Гесс заңы термохимияның негізгі заңы болып табылады, ол келесідей тұжырымдалады:
Изобарлық-изотермиялық немесе изохоралық-изотермиялық жағдайларда жүргізілетін химиялық реакцияның жылу эффектісі оның жүру жолына тәуелсіз, бастапқы заттар мен реакция өнімдерінің энергетикалық күйлерінің айырмасымен анықталады.

Гесс заңының салдары:
1-салдар. Реакцияның энтальпиясы өнім мен реагенттердің түзілу энтальпияларының айырмасына тең.
аА + bB = cC + dD
∆Hр = с∆Нf (C ) + d∆Hf (D) - a ∆Нf (A ) - b ∆Нf (B )
∆Нf жай заттар үшін 0 -ге тең

2-салдар
Реакцияның энтальпиясы реагенттер мен өнімнің жану энтальпияларының айырмасына тең
аА + bB = cC + dD
∆Hр = а∆Нреаг (А ) + b∆Hреаг (B) - c ∆Нреаг (C ) - d∆Нреаг (D )

3-салдар
Реакцияның термохимиялық теңдеуін қосуға, азайтуға, көбейтуге және бөлуге болады, реакция қайтымды болмаса да, теңдеуді оңнан солға қарай жазуға болады.
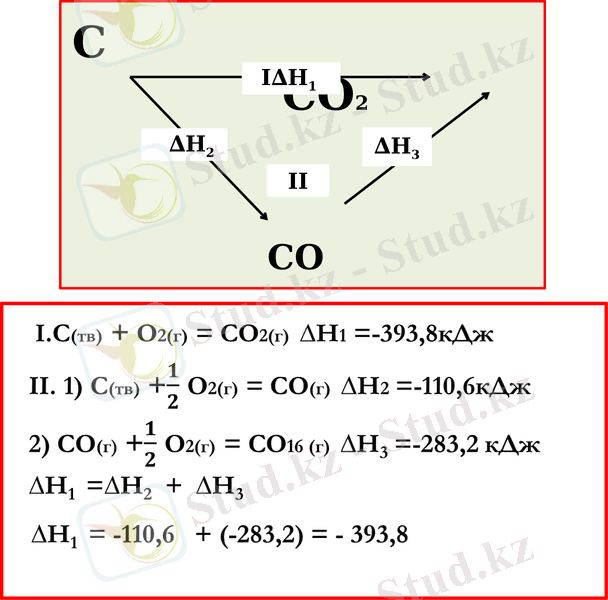
С СО2
СО
I∆Н1
∆Н2
∆Н3
II

Есеп. Реакцияның ∆Н0 есептеңіз:
2Mg + CO2 = 2MgO + C
Егер ∆Н0түз (MgO) = - 601кДж, ∆Н0түз (СO2 ) = - 394кДж
Шешуі.
∆Н0 жай заттар үшін 0-ге тең.
∆Н0 = 2∆Н0түз (MgO) -∆Н0түз (CO2)
∆Н0 = 2(-601) - 1(-394) = - 808 кДж < 0
Реакция экзотермиялық

Анықтамалық мәліметтерді пайдаланып химиялық реакцияның жылу эффектісін Нo298 есептеңіздер:
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(с) ; Нo298 = ?
Егер ∆Н0түз (H2S) = - 20, 60кДж, ∆Н0түз (SO2 ) = - 296, 9кДж, ∆Н0түз (H2 O ) = - 285, 83кДж
Гесс заңының салдарына сай:
∆Но298 = 2∆Ноf, 298(SO2(г) ) + 2∆Ноf, 298(H2O(ж) ) - 2∆Ноf, 298(H2S(г) ) - 3∆Ноf, 298(O2(г) )
∆Н0298 = 2(- 296, 90) + 2(- 285, 83) - 2(- 20, 60) = - 1124, 21 кДж.

Анықтамалық мәліметтерді пайдаланып химиялық реакцияның жылу эффектісін Нo298 есептеңіздер:
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(с) ; Нo298 = ?
Егер ∆Н0түз (H2S) = - 20, 60кДж, ∆Н0түз (NH3 ) = - 46 кДж, ∆Н0түз (H2 O ) = - 286 кДж
Гесс заңының салдарына сай:
∆Но298 = 2∆Ноf, 298(N2(г) ) + 6∆Ноf, 298(H2O(ж) ) - 4∆Ноf, 298(NH3(г) ) - 3∆Ноf, 298(O2(г) )
∆Н0298 = 6(- 286) - 4(- 46) = - 1532 кДж.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz