Фосфор және оның қосылыстары: физикалық және химиялық қасиеттері, алынуы мен қолданылуы



Фосфор және оның
қосылыстары
Химия пәнінің мұғалімі:
Кулман Гулназ Сейсенханқызы
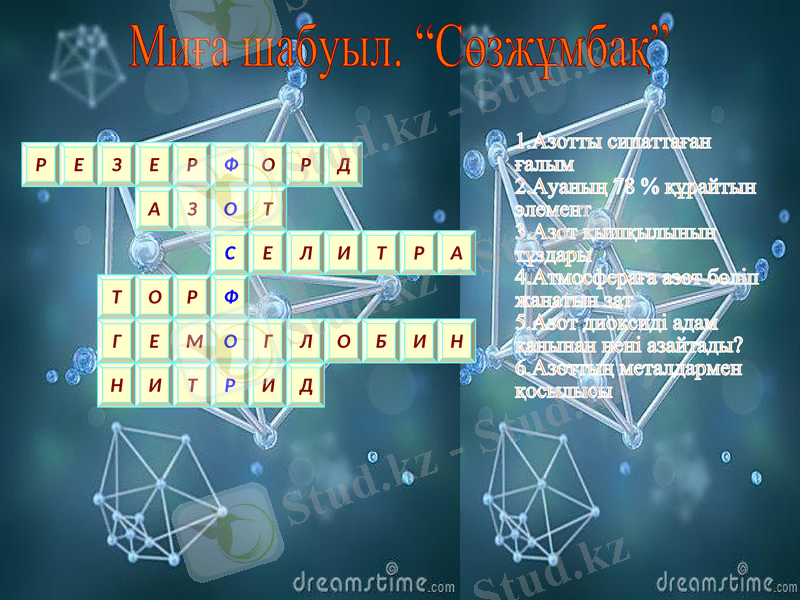
1. Азотты сипаттаған ғалым 2. Ауаның 78 % құрайтын элемент 3. Азот қышқылының тұздары 4. Атмосфераға азот бөліп жанатын зат 5. Азот диоксиді адам қанынан нені азайтады? 6. Азоттың металдармен қосылысы
Миға шабуыл. “Сөзжұмбақ”
Е
Т
З
А
Р
О
Ф
З
Р
Л
Е
С
О
Д
Е
И
Р
О
А
Р
Т
Ф
Е
М
Н
Р
О
И
Г
Т
И
Б
О
Л
Г
Д
И
Т
Н
Р
Е
З
Р
О
Ф
Р
Д
Е
Т
А
З
О
Л
Е
С
И
А
Р
Т
Р
О
Ф
Т
Е
М
О
Г
И
Б
О
Л
Г
Н
Н
Р
И
Д
И
Т

Өткенге шолу
Азот қышқылының физикалық қасиеті қандай?
«Азот» сөзі қандай мағына береді?
Азоттың периодтық жүйедегі орнын, атом құрылысын түсіндір.
Түссіз, өткір иісті, ауадан 2 еседей жеңіл газ?
Азот табиғатта қайда кездеседі?
Азотты қайда қолданылады?
Азотты ашқан ғалым?
Жер қыртысында азоттың мөлшері?
Реакция нәтижесінде бөлініп шыққан бос азотты өлшеуге арналған аспап.
Азоттың ауадағы салмағы мен көлем үлесі?
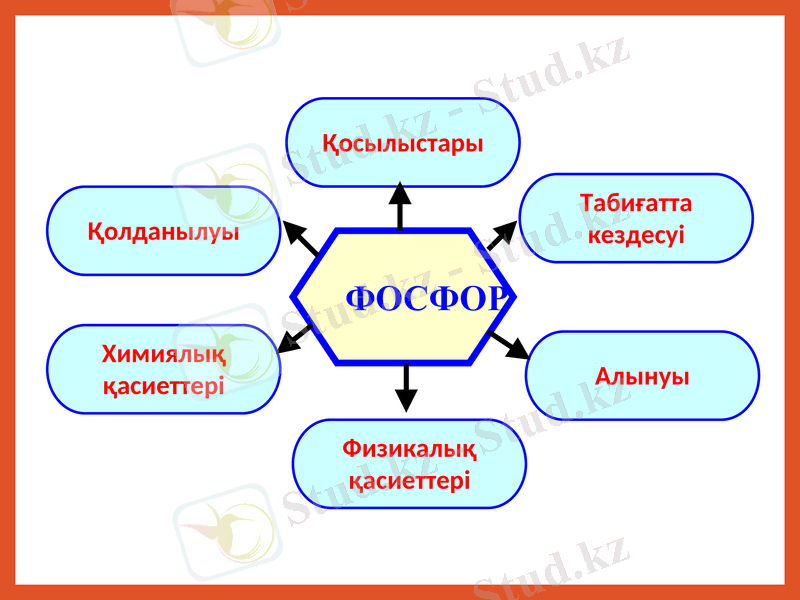
ФОСФОР
Қосылыстары
Қолданылуы
Табиғатта
кездесуі
Химиялық
қасиеттері
Алынуы
Физикалық
қасиеттері

Ашылу тарихы
Фосфорды алғаш ашқан - Гамбургтік алхимик Геннинг Бранд (1669 жылы) . Басқа да алхимиктер тәрізді Бранд қарттарды жасартып, сырқаттарды жазатын өмір элексирі мен асыл емес металдарды алтынға айналдыратын философиялық тасты табуға әрекет жасады. Брандты алға жетелеген адамдардың қамы емес, оның байлыққа құмарлығы болды. Ол жайлы бұл алхимиктің жасаған нағыз, әрі жалғыз табысының тарихи дәйектері куәландырады. Бір тәжірибенің барысында ол зәрді буландырып, алынған қалдықты көмір және құм қосып, буландыруды жалғастырды. Кейін ретортада қараңғыда жарық шығаратын зат түзілді. «Рас», «kaltes Feuer» «суық от» немесе «менің отым» деп Бранд атаған зат қорғасынды алтынға айналдырмады және қарттардың сырт келбетін өзгертпеді, бірақ алынған заттың қыздырусыз жарқырауы ерекше, әрі таңсық болды. Жаңа заттың бұл қасиетін пайдалануды Бранд көп созбады.

Кейін фосфорды беделді адамдарға көрсетіп, олардан сыйлықтар және ақша ала бастады. Фосфордың алыну құпиясын сақтау оңай болмағандықтан, ол оны рездендік химик И. Крафтқа сатып жіберді. Фосфорды алудың әдістемесі И. Кункель мен К. Кирхмейерге белгілі болғаннан кейін оны көрсетушілер саны көбейді. 1680 жылы жаңа элементті, алдындағыларға тәуелсіз, ағылшын физигі әрі химигі Роберт Бойль алды. Бірақ көп кешікпей Бойль қайтыс болды, ал оның шәкірті А. Ганквиц таза ғылымға сатқындық жасап, «фосфор спекуляциясын» қайта жандандырды. Тек 1743 жылы А. Маркграф фосфорды алудың жетілген әдісін тауып, өз мәліметтерін көпшілік назарына жариялады. Бұл оқиға брандтық бизнеске нүкте қойып, фосфор және оның қосылыстарын тыңғылықты зерттеуге бастама болды.

Фосфор (лат. Phosphorus), P - элементтердің периодтық жүйесінің V тобындағы химиялық элемент, реттік нөмірі - 15, атомдық массасы 30, 97. Бірнеше түрі бар: ақ фосфор - тығыздығы 1, 828 г/см3; балқу температурасы - 44, 14°С; қызыл фосфор - тығыздығы 2, 31 г/см3; балқу температурасы - 593°С.

Табиғатта кездесуі
Табиғатта фосфор тау жыныстары мен минералдарда қосылыс түрінде кездеседі. Мысалы, фосфорит және апатитте кальций фосфаты Са3(РO4) 2 түрінде болады. Қазақстанда Жамбыл облысындағы Қаратау маңында фосфорит кенінің мол коры бар екені 1935 жылдан белгілі. Қазір Қаратау бассейні негізінде "Жаңатас байыту комбинаты" жұмыс істейді. Ақтөбе облысында фосфорит кен орнын (Шилісай, т. б. ) игеру жоспарланып отыр.

Фосфорды өңдейтін зауыттар Таразда, Шымкентте және Ақтөбеде бар. Азот тәрізді фосфор да өсімдік пен жануар нәруызының негізгі құрам бөлігі. Фосфор өсімдіктердің дәнінде, жануарлардың сүтінде, қанда, ми мен жүйке ұлпаларында кездеседі. Мысалы, ересек адамдардың сүйегінде 600 г, ет ұлпасында 56 г, жүйке жүйесінде 5 г-ға дейін фосфор болады. Барлық сүтқоректілердің сүйегі құрамында фосфор Са3(РO4) 2 немесе ЗСа3(РO4) 2•СаСO3•Н2O түрінде болады. Осындай фосфаттар сүтқоректілер қаңқасына беріктік қасиет береді. Жануарлар мен адамдар фосфорды өсімдік арқылы қабылдайды. Фосфор қосылыстары тіршіліктегі барлық зат алмасу процестеріне қатысады.

Фосфор элементі жай зат ретінде бірнеше аллотропиялық түрөзгерісін түзеді. Оның маңыздылары - ақ және қызыл фосфор. Ақ фосфор улы жөне тез тұтанатын болғандықтан аса ұқыптылықты қажет етеді. Оның буымен демалуға болмайды. Ақ фосфорды шыны ыдыста, су астында, сыртынан құм салынған металл банкаға орналастырып сақтайды. Ақ фосфор ауасыз кеңістікте қыздырғанда қызыл фосфорға, ал жоғары қысымда қара фосфорға айналады. Қара фосфор аз кездеседі.
Физикалық қасиеттері:

Химиялық қасиеттері:
Фосфор тотыктырғыш (азоттан төмен) және тотықсыздандырғыш қасиет көрсетеді.
Тотыксыздандырғыш ретінде оттекпен және белсенді бейметалдармен реакцияға түседі.
Мырыш фосфиді - зиянкес кемірушілермен күресуде
қолданылатын препарат.
1. Реакция жағдайына байланысты фосфор хлормен (70°С)
әрекеттесіп, фосфор трихлоридін РСІ3 және 300° С-та
фосфор пентахлоридін РСІ5 түзеді:
2. Фосфор сутекпен әрекеттесіп, фосфин РН3 түзеді:
3. Фосфин РН3 - түссіз, ерекше иісі бар, өте улы зат.

Қолданылуы
Қызыл фосфор сіріңке өндіруде, пиротехникада қолданылады. Фосфор жай және күрделі заттармен өрекеттеседі. Қазақстанда фосфор шикізатының қоры Жамбыл (Қаратау) және Ақтөбе (Шилісай) облыстарында бар.
Фосфор сіріңке және улы химикаттар өндірісінде пайдаланылады.
Ақ, қызыл фосфор Н3РО4 алуда, жанғыш қоспалар дайындау үшін қолданылады.
P+5HNО3конц = Н3РО4+5NО2↑ +Н2О

Қызықты дерек:
Сіріңкені 1831жылы 19жасар Шарл Сориа алғаш ойлап тапқан. Бірақ ол сіріңкеге патент ала алмады, себебі ол қымбат болатын. 1832 жылы неміс мұғалімі Камерер сіріңкеге патент алып, оны өндіре бастады. Бірақ оның сіріңкесі ақ фосфордан жасалғандықтан өте қауіпті болды. Қауіпсіз сіріңкені 1848 жылы швед химигі Бетгер алды. Бұл өзіміздің кәдімгі сіріңкеміз, ол қызыл фосфордан жасалады.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz