Химиялық тепе-теңдік: анықтамасы, тепе-теңдік константасы және Ле-Шателье-Браун принципі



Химиялық тепе - теңдік

Жоспар:

·
Химиялық тепе-теңдік - бір немесе бірнеше қарама-қарсы жүретін қайтымды реакциялар жылдамдықтарының теңескен күйі.

Қайтымды реакция аяғына дейін жүрмейді, ол басталғанда тура жүретін реакцияның жылдамдығы (v1) жоғары, кері реакцияжылдамдығы (v2) баяу болады.
Тура реакция жүрген сайын реакцияға алынған заттың концентрациясы азайып, v1 - жылдамдығы кемиді, керісінше, тіке реакциядан пайда болған өнімнің концентрациясы артып, v2 күшейеді.
Біртіндеп екі реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық тепе-теңдік деп атайды.

Тепе-теңдік орнағанмен қарама-қарсы бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай (қысым, концентрация, температура) өзгермесе реакция жылдамдықтары тең болып, химиялық тепе-теңдік орнаған қалпында қала береді, сондықтан оны жылжымалы немесе [динамикалық] тепе-теңдік деп те атайды.

Реакцияласушы жүйенің бір тепе-теңдік күйден басқа басқа тепе-теңдік күйге ауысуын химиялық тепе-теңдіктің ығысуы дейді. Химиялық тепе-теңдік орнаған кездегі реакцияға қатысқан әр заттың концентрациясы тепе-теңдік концентрациясы деп аталады.

Химиялық тепе-теңдікті сан жағынан сипаттайтын көрсеткіш тепе-теңдік константасы (тұрақтысы) (К) деп аталады: aA+bB=pP+qQ, мұндағы бас әріптер - заттардың формулалары, кіші әріптер - реакциядағы молекула сандарын көрсететін коэффициенттер. Тепе-теңдік константасы тура және кері реакциялардың жылдамдық константаларының (k1, k2) қатынасы деп те аталады: K=k1/k2. К - белгілі температурада тура реакция өнімдері мен реакциясы алынған заттардың мольдік көбейтінділерінің қатынасын көрсететін тұрақты шама.

Ле Шателье-Браун принципі,
Ле Шателье-Браун принципі, Ле Шателье - Браун принципі, тепе-теңдіктің ығысу принципі - жүйені термодинамикалық тепе-теңдік күйден ауытқытатын сыртқы әсердің салдарынан сол жүйедегі тепе-теңдік осы әсерді әлсірететін (немесе оған қарсы әсер ететін) реакция бағытына қарай ығысатындығын тұжырымдайтын принцип.
4
1
2
3
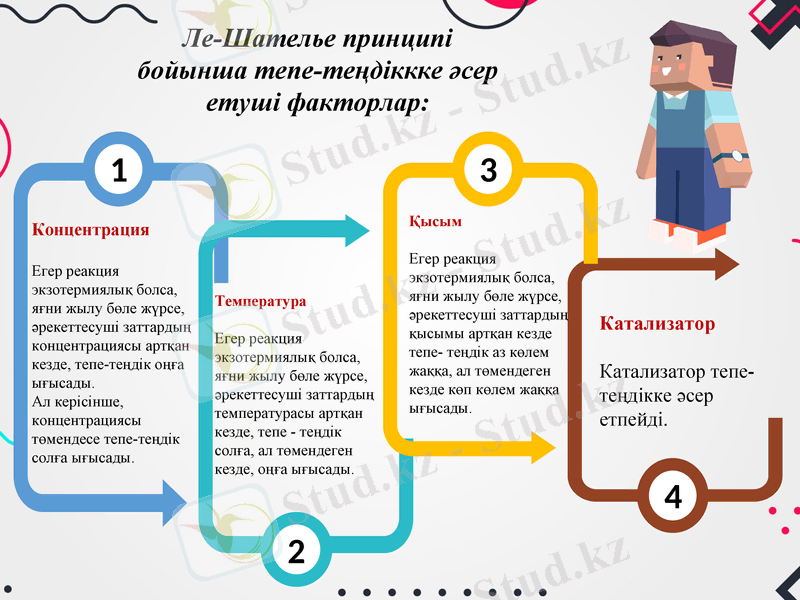
Концентрация
Егер реакция экзотермиялық болса, яғни жылу бөле жүрсе,
әрекеттесуші заттардың концентрациясы артқан кезде, тепе-теңдік оңға ығысады.
Ал керісінше, концентрациясы төмендесе тепе-теңдік солға ығысады.
Температура
Егер реакция экзотермиялық болса, яғни жылу бөле жүрсе,
әрекеттесуші заттардың температурасы артқан кезде, тепе - теңдік солға, ал төмендеген кезде, оңға ығысады.
Қысым
Егер реакция экзотермиялық болса, яғни жылу бөле жүрсе,
әрекеттесуші заттардың қысымы артқан кезде тепе- теңдік аз көлем жаққа, ал төмендеген кезде көп көлем жаққа ығысады.
Катализатор
Катализатор тепе-теңдікке әсер етпейді.
Ле-Шателье принципі бойынша тепе-теңдіккке әсер етуші факторлар:

Ле Шателье, Анри Луи
БРАУН (Braun), Карл Фердинанд

Қорытынды
Егер қайтымды реакция теңдеуінің оң және сол жақтарындағы молекулалар саны бірдей болса, онда қысымның өзгеруі тепе-теңдіктің ығысуына әсер етпейді. Ле Шателье принциін 1885 ж. А. Ле Шателье (1850 - 1936) тұжырымдап, ал теорилық тұрғыдан 1887 ж. К. Ф. Браун (1850 - 1918) негіздеген

Пайдаланылған әдебиеттер:
Уайттен, Дэвис, Пек және Стэнли. (2008) . Химия. (8-ші басылым) . CENGAGE оқыту.
Википедия. (2020) . Химиялық тепе-теңдік. Қалпына келтірілді: en. wikipedia. org

Назарларыңызға
рахмет!!!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz