Аммиак синтезінің өндірістік технологиясы және азот қосылыстарының қолданылуы



Тақырыбы: Байланысқан азот технологиясы.
Аммиак өндірісі

Азот қосылыстары және олардың халық шаруашылығындағы маңызы.
Аммиак синтездеу үшін сутегі мен азотсутек қоспасын алу әдістері.
Аммиакты синтездеудің физика-химиялық негіздері.
Аммиак синтезінің циркуляциялық сызбанұсқасының ерекшеліктері
Аммиак өндірісіндегі катализаторлар.

Өнеркәсіпте сутек пен азотты қосып, тікелей синтездеп, ал лабораторияда аммоний тұздарын сілтімен қосып қыздырып, аммиак алады. Аммиак суда жақсы еріп, аммоний гидроксидін, ал қышқылдармен реакцияға түсіп, аммоний тұздарын түзеді. Аммоний тұздарының барлығы суда жақсы ериді. Оларды қыздырғанда, аммиак бөле ыдырайды.
Аммоний тұздары азот қышқылын алуға, тыңайтқыштар өндіруге, қопарылғыш заттар жасауға қолданылады. Аммоний нитраты мен аммоний сульфаты, аммоний гидрофосфаттары тыңайтқыш ретінде кеңінен қолданылады.
Аммоний хлоридін: дәнекерлеуге, гальвани элементін даярлауға, ал аммоний гидрокарбонатын: кондитер, тамақ өнеркәсібінде қолданылады.
Аммоний нитраты NH4NO3, алюминий және көмірдің коспасынан аммонал деп аталатын копарылғыш зат жасалынады.

Азот қосылыстары өндірістің әр түрлі салалары мен ауыл шаруашылығында маңызды роль атқарады.
Мысалы: азот қышқылы HNО3 минералды тыңайтқыш, талшықтар, нитраттар және жарылғыш заттар өңдірістері, бояу, дәрі-дәрмек дайындауда қолданылады. Азот тыңайтқыштары ауыл шаруашылығында кеңінен қолданылады.
Аммиак өндіріс көлемінде атмосферадан азот алатын маңызды азот қосылысы.
NH3 Аммиак - түссіз, өткір иісті, ауадан екі еседей жеңіл, тұншықтырғыш, өткір иісті түссіз газ.
t қайнау =33, 35 0C
t балқу=77, 75 0С
Суда жақсы ериді. Сұйық NH3 сілтілік, сілтілік - жер металдарын фосфор, S, I және көптеген бейорганикалық және органикалық қосылыстарды ерітеді.

Табиғатта кездесетін чили селитрасының (NаNО3) қоры аз болғандықтан, азот қосылыстарын өндірудің басқа жолдары іздестірілді. Селитрадан басқа азот өндірілетін табиғи қор табу қажет болды. Ал азоттың таусылмас қоры атмосфералық ауада бар. Аммиак өндіру үшін өндірісте азотты - ауадан, сутекті - табиғи газдан бөліп алуға болады.
Аммиак синтезін өндірісте жүзеге асырған неміс инженері Карл Бош болды. Ол көптеген практикалық мәселелерді шешті. Алдымен аммиак синтезіне қажетті шикізаттар - азот пен сутекті таза күйде алу қажет болды.
Аммиак синтезіне қажетті азотты ауадан алу үшін ауаны қысыммен төмен температураға дейін салқындатады да, толығымен сығады. Сұйық ауаның құрамына кіретін басқа заттардан азотты айдау арқылы бөледі
Аммиак өндірісінің шикізаты шексіз, екінші компонент сутегі кокс газын бөлу арқылы, қатты отынды газификациялау, табиғи газды конверсиялау арқылы алынады. 30% аммиак табиғи газ негізінде алынады.
Аммиак өндірісінің шикізаты азотсутектік қоспа
N2 : H2 = 1 : 3

N2 + ЗН2 ↔ 2NН3 + 92, 7 кДж
Теңдеуден көрініп тұрғандай реакция қайтымды және экзотермиялық, көлемнің кемуімен жүреді.
Ле-Шателье принципі бойынша температураны төмендетіп, қысымды арттырғанда тепе-теңдік аммиак түзілу бағытына ығысады.
Бірак төменгі температурада реакцияның жылдамдығы кеміп, аммиактың шығымы азаяды. Сондықтан төменгі температурада реакция жылдамдығы жоғары болу үшін белсендіру энергиясын азайтатын катализатор қажет.

Азоттың активтендіру энергиясын арттыру үшін катализатор қолданады. Зерттеу нәтижесі бойынша тиімді катализатор промоторланған Ғе катализаторы, промотор есебінде АІ2О3, К2О, СаО, SіO2 қолданылады. Оттек және оның қосылыстары көміртек оксиді, Ғе қайтымды, күкірт қосылыстары қайтымсыз уландырады.
Көп зерттеулер нәтижесінде аммиакты синтездеудің тиімді жағдайы: 200 - 4500С және 20-100 МПа қысымда шығым 15-20 пайыз болатыны анықталды. Түзілген аммиакты бөліп алу үшін газдар қоспасын салқындатып, аммиакты конденсациялайды. Реакцияға түспеген азот-сутек қоспасын қажетті мөлшерде азот пен сутек қосып, процеске қайта жібереді.

Өндірісте NH3 2 сортта өндіреді
1) сұйық аммиак
2) сулы ерітіндісі (аммиакты су)
Аммиак МЕСТ бойынша 2 сортта өндіріледі:
І сорт 99, 9 %,
ІІ сорт 99, 6 %
Аммиакты синтездеудің қысымға байланысты 3 әдісі:
1) төмен қысымдағы 10-15МПа
2) орта қысымдағы 25-60МПа
3) жоғары қысымдағы 60-100МПа
Тиімдісі: орта 25-60 МПа
N2 + 3H2 = 2NH3 + 112 КДж (5000С, 30МПа)

1) CH4 + H2O ↔ 3H2 + CO - Q
СН4 + ½ O2 ↔ 2H2 + CO + Q
2) 500°С
CO + H2O → H2 + CO2 + Q
Fe2O3
3) N2 + 3H2 = 2NH3 + 112 КДж (5000С, 30МПа)
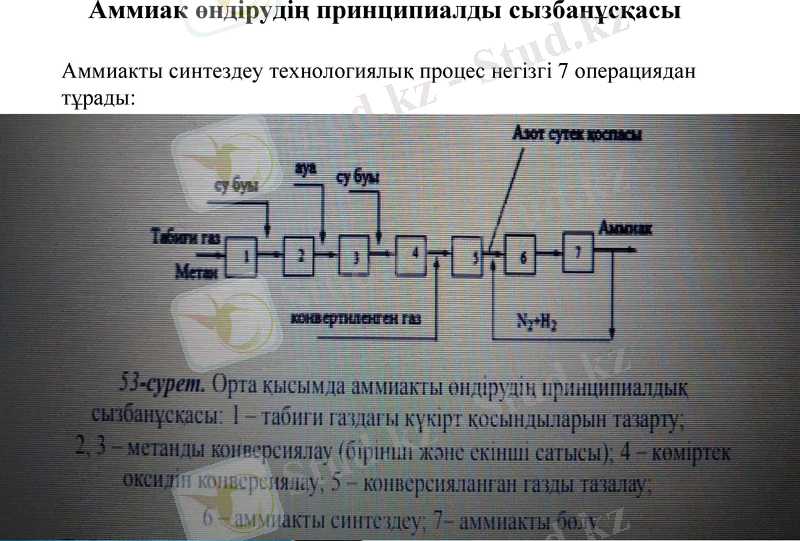
Аммиак өндірудің принципиалды сызбанұсқасы
Аммиакты синтездеу технологиялық процес негізгі 7 операциядан тұрады:

Аммиак өндірудің сатылары
Табиғи газды күкірттен тазартады, өйткені олар катализаторды улап
реакцияның жылдамдығын төмендетеді. Тазартылған газға су буын
қосып, газ бен будың қоспасын метанды конверсиялауға 1-ші сатысына
жібереді. Метанды конверсиялау реакциясы:
CH4 + H2O ↔ 3H2 +CO - Q
Метанды каталитикалық жолмен конверсиялаудың бірінші сатысы
Nі / АІ2О3 катализаторы қатысында, 800°C температурада, 1 - 4 МПа (табиғи
газ қысымы) қысымда жүргізіледі. Бұл сатыда конверсия толық жүрмейді.
Əрі қарай толық тазалау үшін, осы шыққан сулы газға ауа қосып, екінші сатыға жібереді. Метанның бір бөлігі ауадағы оттегімен қосылады (метаннның ауадағы оттегімен конверсиясы) :
СН4 + 1/2O2 ↔ 2H2 + CO + Q

Осы реакция бойынша бөлінген жылу екінші сатыға керек жылуды қамтамасыз етеді. Бұл жерде ауамен бірге азотты қосып, азот сутек қоспасын алады. Алынған газ қоспасына су буын қосып (3), CO конверсиясына (4) жібереді.
Көміртек оксидінің конверсиясы жүреді:
500°С
CO + H2O → H2 + CO2 + Q
Fe2O3
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz