Ферменттер: құрылымы, әсер механизмі және биохимиялық маңызы



Ферменттер
Орындаған:Жақатова Динара
Қабылдаған: Мусина Айтжамал Слямханова
«Қазақ Ұлттық қыздар педагогикалық университеті» КеАҚ

Фермент туралы жалпы түсінік
Ферменттердің химиялық құрамы және құрылымы
Ферменттер атаулары мен классификациясы
Ферменттер әсерінің теориясы
Ферменттік реакциялардың кинетикасы
Ферменттер қасиеттері
Иммобилденген ферменттер
Ферменттердің практикалық маңызы
Ферменттерді және олар катализдейтін реакцияларды зерттейтін биохимия бөлімі энзимология деп аталады.
ХІХ ғасырдың ортасында кейбір фермент препараттары (уыттан - амилаза, қарын сөлінен пепсин, т. б. ) бөлініп алынды.
Ең алғаш таза ферментті 1926 ж. жас биохимик Дж. Самнер кристалл түрінде алды.
Зерттеліп табылған ферменттердің саны 6000-ға жуық. Олардың бәрі де белокты заттар.
Ферменттердің бәрі де үлкен молекулалы қосылыстар, олардың молекулалық массасы 10мыңнан 1млн-ға жетеді.

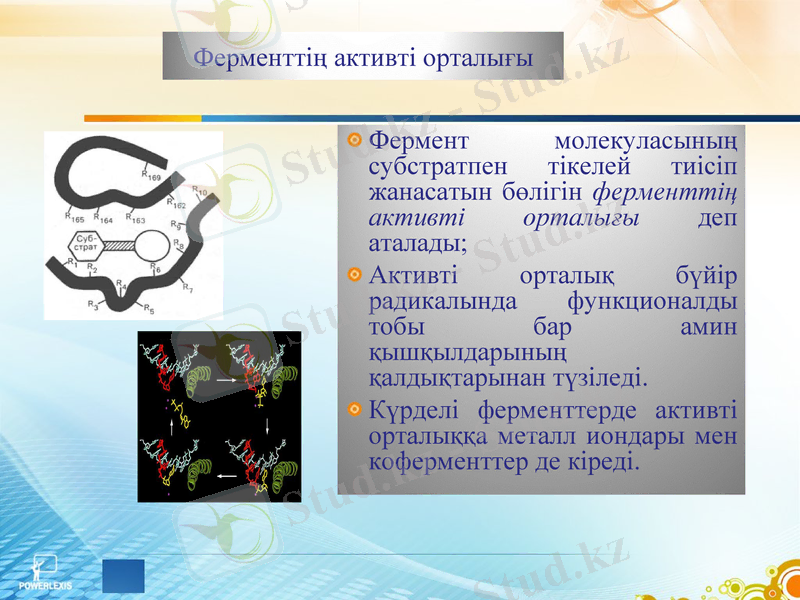
Ферменттің құрылысы
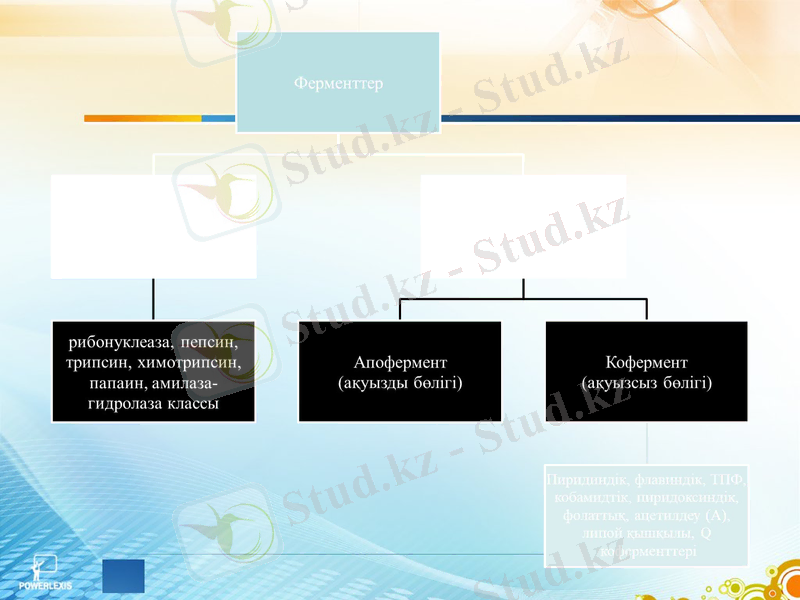
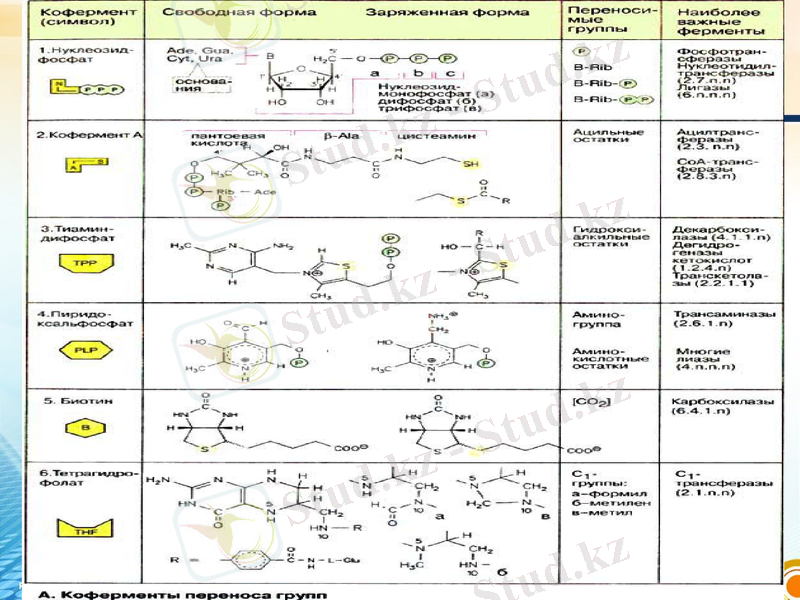


Ферменттер атаулары
Жүйелік атау: әр ферменттің номері (шифры) болады, ол төрт саннан тұрады.
Бірінші сан ферменттің класын білдіреді,
Екінші сан класс тармағын,
Үшінші сан класс тармағы бөлігін,
Төртінші сан өз тармағындағы номерін көрсетеді. Мысалы, 2. 7. 1. 2. АТФ: глюкоза-6-фосфотрансфераза.
Тривиалдық атаулар екі жолмен пайда болады:
1) Фермент әсер ететін субстрат атауына -аза жұрнағы қосылады. Мысалы, мальтозаны екі молекула глюкозаға гидролиздейтін фермент мальтаза.
2) Фермент катализдейтін реакция атауына -аза жұрнағы қосылады (оксидаредуктаза) .
Кейбір ферменттердің тарихи қалыптасқан атаулары бар. Мысалы, пепсин, трипсин, папаин, эластаза, т. б.
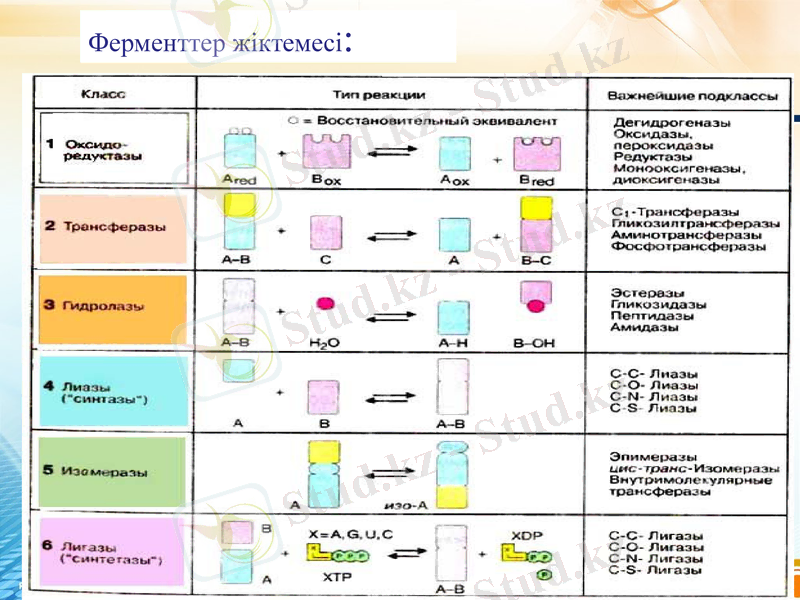
Ферменттер жіктемесі:
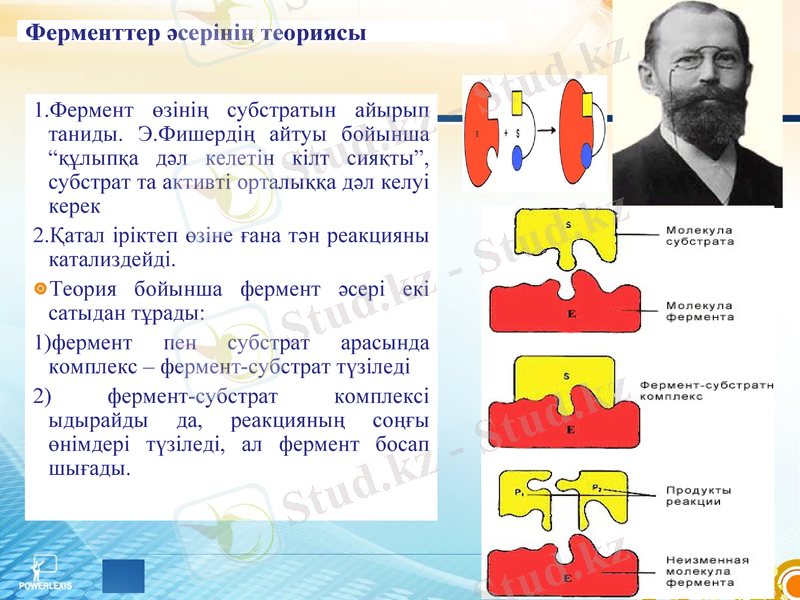
Ферменттер әсерінің теориясы
Фермент өзінің субстратын айырып таниды. Э. Фишердің айтуы бойынша “құлыпқа дәл келетін кілт сияқты”, субстрат та активті орталыққа дәл келуі керек
Қатал іріктеп өзіне ғана тән реакцияны катализдейді.
Теория бойынша фермент әсері екі сатыдан тұрады:
1) фермент пен субстрат арасында комплекс - фермент-субстрат түзіледі
2) фермент-субстрат комплексі ыдырайды да, реакцияның соңғы өнімдері түзіледі, ал фермент босап шығады.

Ферменттік реакциялар кинетикасы
Ферменттік реакциялар кинетикасы деп реакция жүру жылдамдығын айтады.
Реакция жылдамдығын белгілі бір уақыт өлшемінде фермент әсерімен түзілген өнім бойынша (немесе субстраттың жойылу мөлшері бойынша) есептейді.
Л. Михаэлис пен М. Ментен бойынша: фермент концентрациясы тұрақты кезде реакция жылдамдығы субстрат концентрациясына байланысты.
Реакция жылдамдығы субстрат концентрациясына пропорционал болмайды.

Ферменттердің қасиеттері
Ферменттік реакциялар жылдамдығына температураның әсері;
Ортаның рН көрсеткішінің әсері;
Фермент әсерінің ерекшелігі;
Фермент активаторлары мен ингибиторлары;
Проферменттер және оларды активтендіру;
Изоферменттер;
Мультиферменттік жүйе.

Реакцияның жылдамдығын арттырғанда фермент:
тек өзінің ғана субстратын байланыстырады және сол субстратты катализдейді.
тек өз субстратын танып білуі, байланыстыруы және ары қарай реакция катализін жүргізуі- бұл ферменттің өзіне тән ерекшелігі деп аталады.
Кейде фермент ұқсас құрылымы бар субстраттар тобына да әсер етеді және молекуладағы белгілі бір химиялық байланыстарды ажыратып бөледі.

Ферменттердің практикалық маңызы
Бактериалдық ашу
Физиологиялық реттегіш
Катализ
Жасушалық метаболизм
Макромолекулалар
Генетикалық аппарат
Тамақтану
Мембраналар ультрақұрылысы
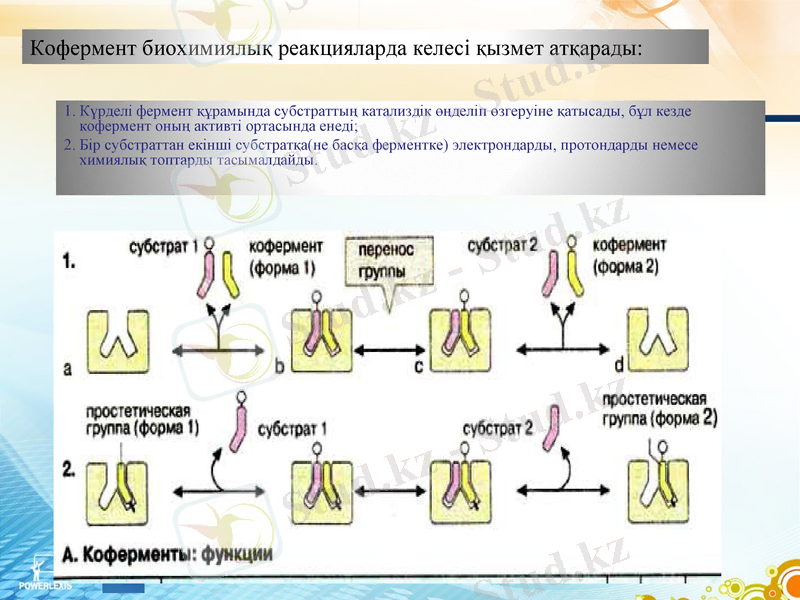
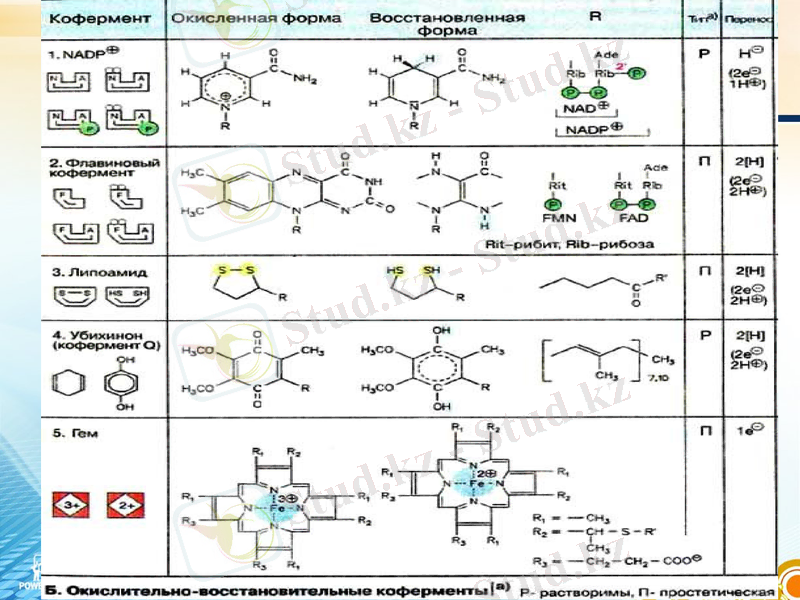
Коферменттер
Фармокология
Биосинтез
Реакциялар кинетикасы
Энергия айналуы
Биохимиялық эволюция
Тума зат алмасу бұзылуы

Қорытынды
Ферменттер - ағзадағы химиялық реакциялардың жылдамдығын жүздеген және мындаған есе өзгерте алатын белокты заттар, атап айтқанда жекелеген қосындылардың синтезі мен ыдырауын, зат алмасу процестерін және тағы сол сияқтыларды шапшаңдататын заттар.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz