Нитроқосылыстар: химиялық құрылымы, физика-химиялық қасиеттері және алыну әдістері



Нитроқосылыстар
ОРЫНДАҒАН:АЙМАНОВА. А
ТОБЫ:ХТ-21-9К2
ҚАБЫЛДАҒАН:АБЖАЛОВ. Р

Жалпы сипаттамасы
Құрамында азот қышқылының қалдығы функционал NО2 тобы бар органиклық қосылыстарды нитроқосылыстар дейді. Олар табиғатта кездеспейді. Бірақ күрделі органикалық синтезде шикізат ретінде кеңінен қолданылады. Ондағы нитро топты органикалық қосылыстарға оңай енгізуге болады, ал содан соң оны кез келген басқа функционалды топтарға ауыстыру жеңіл. Сөйтіп, нитроқосылыстар органикалық синтездің мүмкіншіліктерін көбейтуге көмектеседі.
Нитрокосылыстардың аталуы өздеріне сәйкес көмірсутекті қосылыстарға негізделеді:
Алифатты қатардағы нитроқосылыстарды өздеріне сәйкес басқа кластағы қосылыстар мен молекула салмағына орай салыстырғанда, олардың қайнау температуралары біршама жоғары айталық, нитрометан 101°С-та, ннтроэтан 114°С қайнайды. Ароматты нитротуындылар одан да жоғары температурада қайнайды. Нитробензол 20°С-та, о-нитротолуол 222° С-та қайнайды. Құрамында бірнеше нитро тобы бар қосылыстар қатты болады және олар қопарғыш заттар ретінде жиі қолданылады.
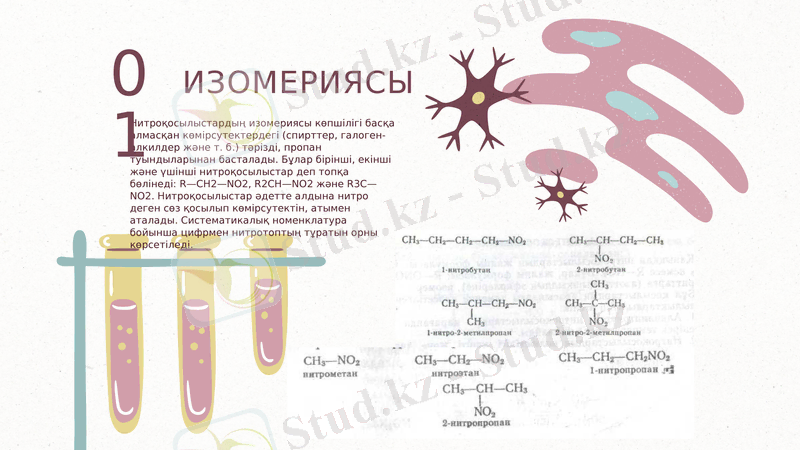
ИЗОМЕРИЯСЫ
Нитроқосылыстардың изомериясы көпшілігі басқа алмасқан көмірсутектердегі (спирттер, галоген-алкилдер және т. б. ) тәрізді, пропан туындыларынан басталады. Бұлар бірінші, екінші және үшінші нитроқосылыстар деп топқа бөлінеді: R-CH2-NO2, R2CH-NO2 және R3C-NO2. Нитроқосылыстар әдетте алдына нитро деген сөз қосылып көмірсутектін, атымен аталады. Систематикалық номенклатура бойынша цифрмен нитротоптың тұратын орны көрсетіледі.
01

АЛЫНУЫ
ГАЛОГЕНДІ АЛКИЛДЕР ХЛОРЛЫ СІРКЕ ҚЫШҚЫЛЫНАҚ ӘЛСІЗ ДЕ, АКТИВСІЗДЕУ КЕЛЕДІ. ЕГЕР НАТРИЙ НИТРИТІНІҢ ОРНЫНА КҮМІС НИТРИТІН ГАЛОГЕНДІ АЛКИЛ АЛСА, ЕРІМЕЙТІН КҮМІС ТҰЗЫНЫҢ ТҰНБАСЫ ШӨККЕНДІКТЕН РЕАКЦИЯ СОҢЫНА ДЕЙІН ЖҮРЕДІ:
Өндірісте нитроқосылысты негізінде алкандарды тікелей нитрлеу арқылы алады. Ал, қалған кейбір әдістері мыналар:
Нитрит-анионды алкилдеу:
Малон қышқылы сияқты, нитросірке қышқылы да оп-оңай СО2-ні бөледі. Хлорлы сірке қышқылының эфирін, оның натрий тұзымен алмастырса, нитрометан шығады:

Май қатарының нитроқосылыстары - жағымды иісті сұйық заттар, ыдырамай тұрғанда айдалып шығарылады; суда аз ериді, улы, металдарды химиялық бүлдірмейді, судағы ерітіндісінің реакциясы нейтрал келеді. Көміртек атомдарының саны 4-тен кем болса қосылыстың тығыздығы 1-ден ауыр, ал егер 4-тен немесе одан көп болса 1-ден жеңіл келеді.
ФИЗИКАЛЫҚ ҚАСИЕТТЕРІ

ХИМИЯЛЫҚ ҚАСИЕТІ
формуладағы азотқа келсек, ол бес валентті. Ол үшін оның он электроны болуы керек. Бірақ азот Менделеев таблицасындағы екінші периодтың элементі. Оның ең сыртқы электрон қабығы тұрақты инертті газ түріне жету үшін, оғаи электрон қажет. Демек, оны дұрыстап өрнектеу үшін азоттың оттекпен бір байланысын еселенген, ал екінші байланысын семиполярлы байланыспен өрнектеген жөн, яғни азот бөлінбеген қос электронын оттскке береді:
Семиполярлы байланыстың пайда болуы азотта оң, оттекте теріс зарядтың болуына әкеп соғады:
Шын мәнісінде нитрототықтағы оттек атомдарының екеуі де бірдей тең валентті. Оны тепе-теңдік жағдайда көру үшін, былай да өрнектеуге болады:
Ацилат-ионынан нитроқосылыстардың айырмашылығы, ондағы орталық азот атомы оң зарядталған. Од заряд -жағдайдағы көрші сутек атомына әсер етеді. Мұның салдарынан нитро топта аса күшті индуктивті және қабысу әсерлері пайда болады. Бұл нитро топты тұрақтандырады:
Бұл екі әсердің салдарынан нитрометанға кушті кышкылдық қасиет тән болады, ол тіпті сілтініи судагы әлсіз ерітіндісімен де тұз құрайды.
Оны қышқылмен өңдегенде, ол әуелі нитроалкандарға изомерлі ациннтроқосылысын береді. Ол тұрақты нитро түрмен тепе-теңдікте болады.

Нитроқосылыстар альдегидтер және кетондармен әрекеттескенде β-нитроспирттер құралады. Бұл рсакцияларда нитрокосылыс анионы карбений анионы іспеттес әрекеттеседі:
Нитрокосылыстар активтелген олефиндермен конденсацияланады. Оны Михаэл реакциясы деп те атайды. Мысалы, активтелген акрил қышқылының туындысын алайық:
Нитрокосылыстардағы активті сутек атомы негіздердің қатысуымен галогендерде алмасады. Бұл реакция көмегімен біріншілік нитроқосылыстарды екіншіліктен айыруға болады.

Қопарылу кезінде тотығу-тотықсыздану реакциясы жүріп көміртек СО2, сутек Н2О, ал нитро топ бос азотқа айналады. Оны жалпы түрде былайша өрнектеуге болады:
C2H4N2O9 → 2CO2+2H2O + N2
ҚОЛДАНЫЛУЫ
Қопарғыш ааттар ертеден белгілі. Олардың тұңғыш өкілі қара дәрі - оқк-дәрісі (немесе оны түтінді оқ-дәрі деп те атайды) . Ағаш көмірі, күкірт қоспасы мен тотықтырғыштан (селитра) тұрады. Бұл қоспаны oт тигізіп, жандырғанда, тотығу-тотықсыздану реакциясы жүреді. Мұның нәтижесінде көмір CO жәпе СО2-ге, ал күкірт SO2-ге дейін тотықса, ондағы селитра азот және оның тотығына дейін тотықсызданады. Осындай оқ-дәрісі мылтық, зеңбірек сияқты қарулардың ұңғысында от алса, көп газ бөлініп, ондағы қысым күрт көтеріледі. Оның күшімен оқ ұша жөнеледі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz