Коферменттер: химиялық құрылымы, классификациясы мен биохимиялық қызметі



Коферменттер және олардың реакцияларға қатысуы
Орындаған: Елемес Гүлбану Қазбекқызы Группа:6В01509-биология Қабылдаған:Иманова Эльмира Мырзабековна.
Қазақ Ұлттық Қыздар Педагогикалық Университеті
Жаратылыстану институты
Биология кафедрасы
СӨЖ

Кіріспе
Негізгі бөлім
Коферменттер туралы жалпы түсінік
Коферменттердің түрлері
Коферменттердің химиялық құрылымы мен қызметі
Коферменттердің классификациясы
Қорытынды
Пайдаланылған әдебиеттер
Жоспары:

Кіріспе
Коферменттер немесе Коэнзимдер (лат. Ко - «бірге» жəне фермент) - құрамында белок жоқ органикалық қосылыстар, олар апорферментепен тығыз байланысқан. Ферменттің мықты байланысқан кофакторы - простетикалық топ. Көптеген ферменттердің активтігі үшін екі фактордың да - металл иондарының да, простетикалық топтың да (немесе коферменттердің) болуы қажет
Коферменттер - толық молекулалы заттар, олар жоғары температураға төзімді келеді жəне ферменттің белоктық бөлігінен оңай ажырайды. Мысалы, диализ кезінде осылай болады. Олар сөзсіз қажетті кофактор ретінде ферменттердің катализдік жұмысына қатысады.
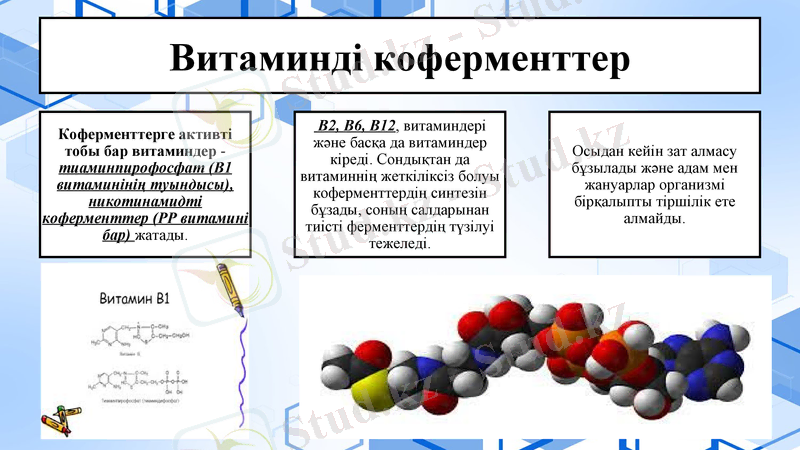
Витаминді коферменттер
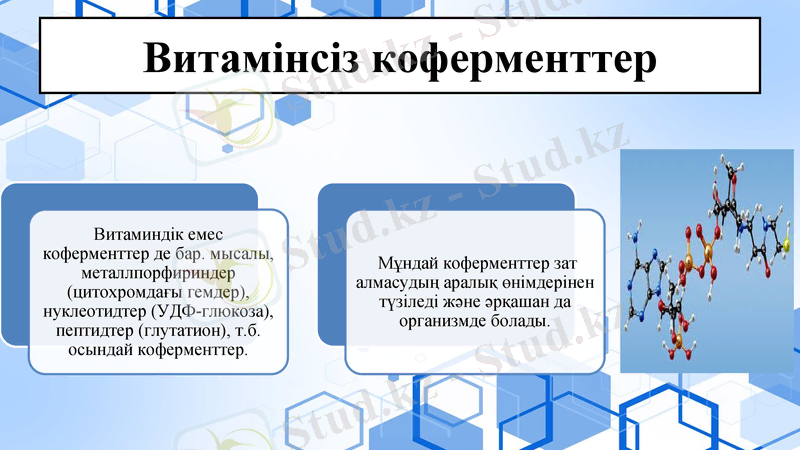
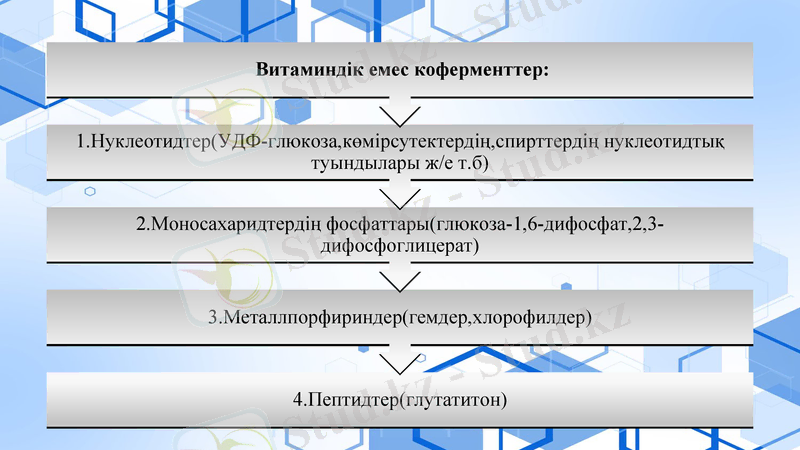
Витамінсіз коферменттер

Витаминдық коферменттер:
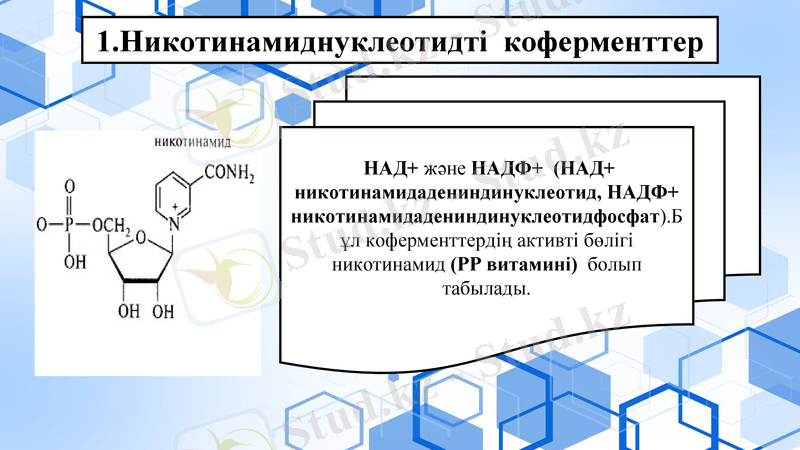
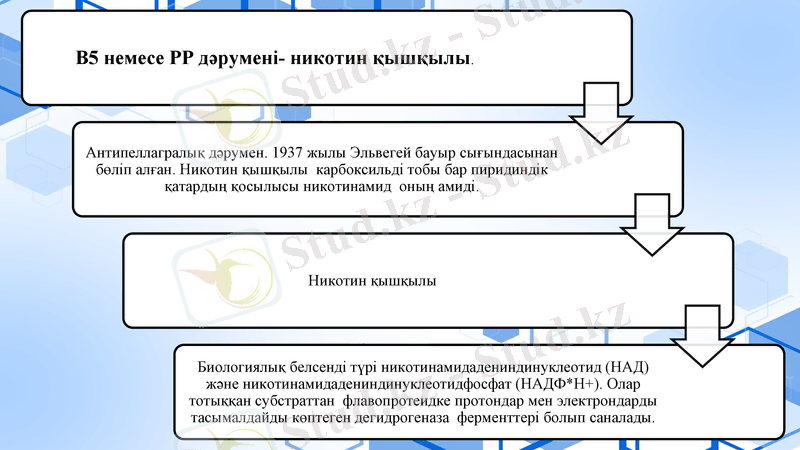
НАД+ және НАДФ+ (НАД+ , НАДФ+ ) . Бұл коферменттердің активті бөлігі никотинамид (РР витамині) болып табылады.
1. коферменттер

2. ФАД және ФМН флавиндік коферменттер.
Бұлардың пайда болу көзі-рибофлавин. ФАД және ФМН коферменттері әртүрлі апоферменттермен баиланысады да, флавопротидті ферменттер-флавиндік дегидро геназа түзеді. Қазіргі кезде флавопротеидтердің саны 80 шамасына жетеді
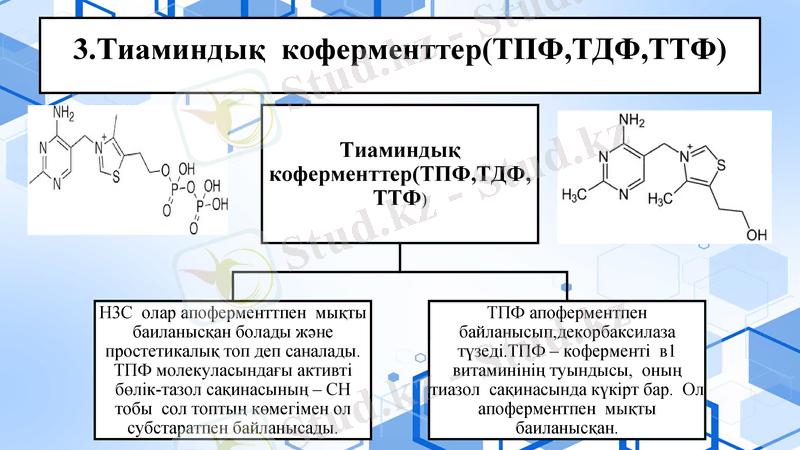
3. Тиаминдық коферменттер(ТПФ, ТДФ, ТТФ)

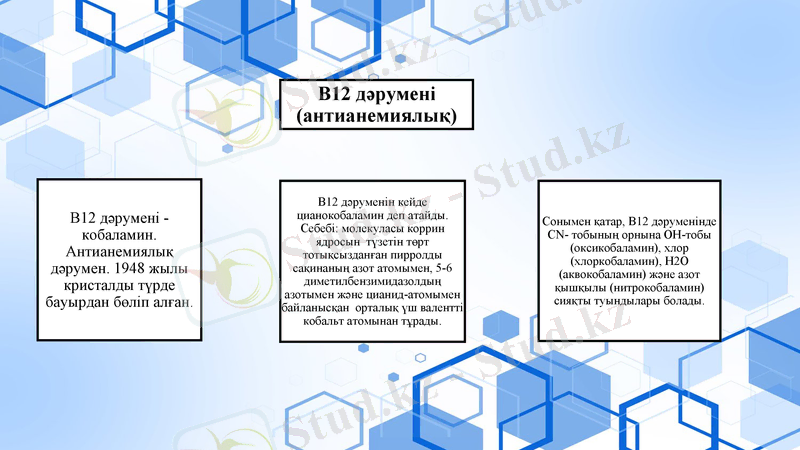
4. Кобамидтік коферменттер.
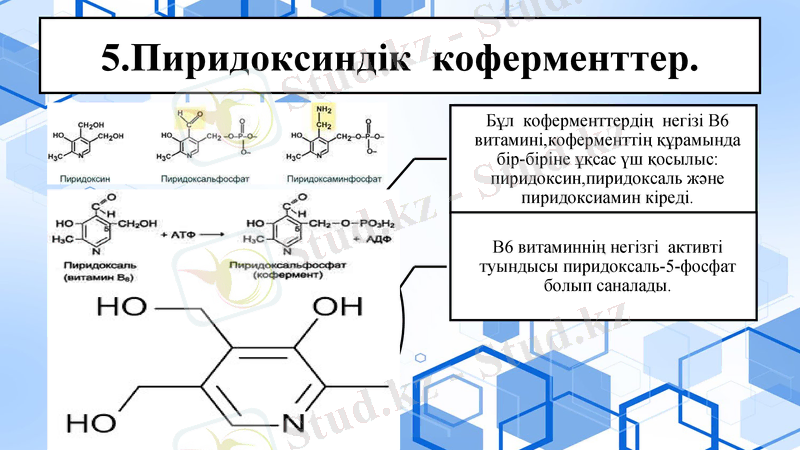
5. Пиридоксиндік коферменттер.

В1 дәрумені (антиневриттік)
В1 дәрумені - тиамин. Антиневриттік дәрумен. 1912 жылы Функ алғаш рет кристалл түрінде бөліп алып, В1 дәруменінің құрамында аминотоптан басқа күкірт атомы болғандықтан, тиамин депаталады.
В1 дәрумені -тиаминохлорид
В1 дәруменінің биологиялық белсенді түрі тиаминдифосфат (ТДФ) болып табылады. ТДФ күрделі екі ферменттік жүйенің - пируват және а - комплекстің құрамына кіреді. полимерфттік комплекс ацетил -SkoA және СО2 түзілетін пирожүзім қышқылының тотыға декарбоксилденуін катализдейді.


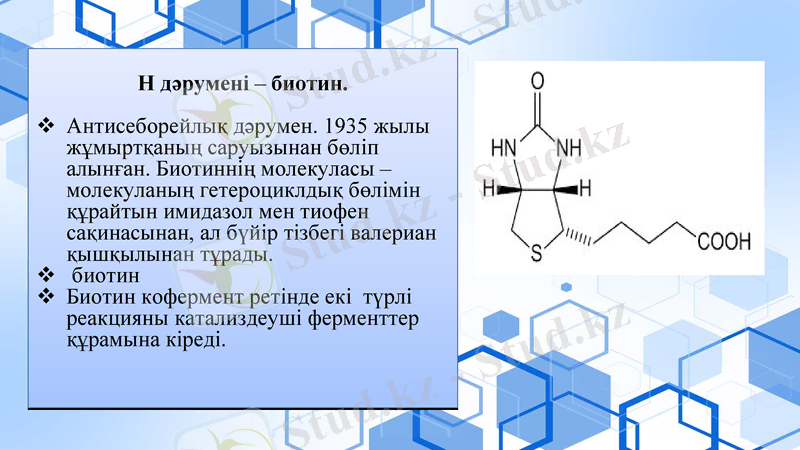
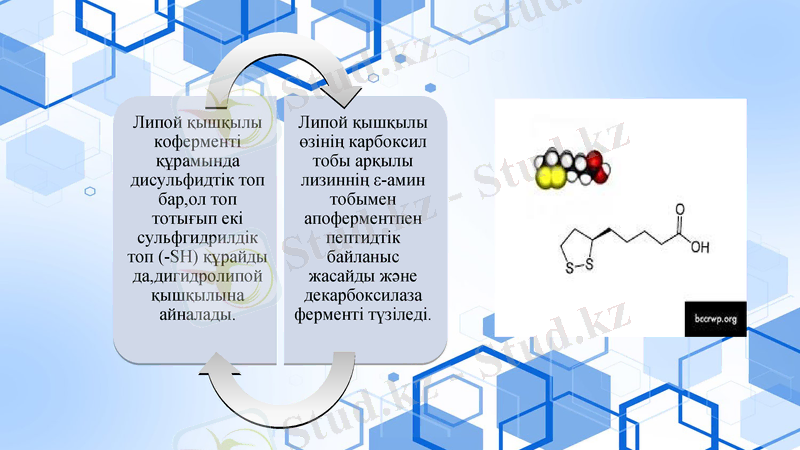
Н дәрумені - биотин.
Антисеборейлық дәрумен. 1935 жылы жұмыртқаның саруызынан бөліп алынған. Биотиннің молекуласы - молекуланың гетероциклдық бөлімін құрайтын имидазол мен тиофен сақинасынан, ал бүйір тізбегі валериан қышқылынан тұрады.
биотин
Биотин кофермент ретінде екі түрлі реакцияны катализдеуші ферменттер құрамына кіреді.
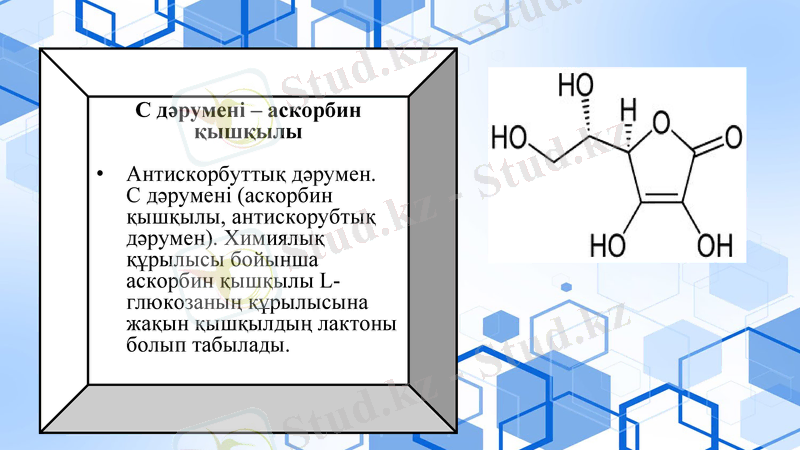
С дәрумені - аскорбин қышқылы
Антискорбуттық дәрумен. С дәрумені (аскорбин қышқылы, антискорубтық дәрумен) . Химиялық құрылысы бойынша аскорбин қышқылы L- глюкозаның құрылысына жақын қышқылдың лактоны болып табылады.


Қорытынды
Коферменттер немесе Коэнзимдер (лат. Ко - «бірге» жəне фермент) - құрамында белок жоқ органикалық қосылыстар, олар апорферментепен тығыз байланысқан. Ферменттің мықты байланысқан кофакторы - простетикалық топ. Көптеген ферменттердің активтігі үшін екі фактордың да - металл иондарының да, простетикалық топтың да (немесе коферменттердің) болуы қажет.
Коферменттер - толық молекулалы заттар, олар жоғары температураға төзімді келеді жəне ферменттің белоктық бөлігінен оңай ажырайды. Мысалы, диализ кезінде осылай болады. Олар сөзсіз қажетті кофактор ретінде ферменттердің катализдік жұмысына қатысады.

Пайдаланылған әдебиеттер тізімі:
1. Т. С. Сейтембетов, Биологиялық химия, Алматы 2011 жыл
2. С. О. Тапергенов, Медициналық биохимия, Алматы 2011 жыл
3. З. С. Сейтов, Биологиялық химия, 2012 жыл
4. http://stud24. ru/chemistry/kofermentter/411136-1404480-page1. html
5. https://kk. wikipedia. org/wiki/Коферменттер

Назарларыңызға рахмет!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz