Тотығу-тотықсыздану реакциялары: тотығу дәрежелері, электрондық баланс және теңестіру әдістері



ТОТЫҒУ- ТОТЫҚСЫЗДАНУ РЕАКЦИЯСЫ

Реакциялардағы элементтердің тотығу дәрежесін қойыңдар.
Реакция барысында тотығу дәрежелері қалай өзгеретінін салыстырыңдар.
HCl + NaOH = NaCl + H2O
2 HCl + Zn = ZnCl2 + H2
+ 1 - 1 + 1 - 2 + 1 + 1 - 1 + 1 - 2
+ 1 - 1 0 + 2 - 1 0
Элементтердің тотығу дәрежелері өзгере жүретін реакциялар тотығу -тотықсыздану реакциялары деп аталады.
Тотығу тотықсыздану
реакциясы

- 2 е-
2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20
Zn0
2 H+
Zn+2
H20
+ 2 е-
тотығу
тотықсыздану
H+
Zn0
- тотықтырғыш
- тотықсыздандырғыш

ТОТЫҒУ - электрондар беру үрдісі.
ТОТЫҚСЫЗДАНУ-электрондар қосып алу үрдісі.
ТОТЫҚТЫРҒЫШ - электронды қосып алатын элемент.
ТОТЫҚСЫЗДАНДЫРҒЫШ - электрон беретін элемент.

Э+1
Э+2
Э-2
Э-1
Электрон бере ме жоқ әлде қосып ала ма?
+5
Бастапқыда атом зарядсыз, яғни протондар саны мен электрондар саны тең
-
-
-
-
-
-
-
Э0
Электрондар береді (- е-)
-
-
Электрондар қосып алады (+ е-)

ТТР-сы теңдеулерін теңестіру реті төмендегідей: 1. Химиялық реакция теңдеулерін жазу.
Al+H2SO4 Al2(SO4) 3+H2
2. Теңдеулердің оң және сол бөлігіндегі барлық әлементтердің тотығу дәрежелерін тауып, таңбасының үстіне жазу. 0 +1 + 6 -2 +3 +6 -2 0 Al+H2SO4Al2(SO4) 3+H2
3. Реакция нәтижесінде тотығу дәрежесі өзгерген элементтердің астын сызу.
0 +1+6-2 +3 +6 -2 0 Al + H2SO4 Al2(SO4) 3 + H2

4. Электрондық баланс теңдеуін құру:
Al - 3ē Al +3 3 2 2H+1 + 2ē H2 0 2 3
5. Таңдалған коэффиценттерді реакция теңдеуіне жазу.
2Al+3H2+1S+6O4-2 =Al2+3(S+6O4-2) 3+3H2
6. Оттек атомдарының санын есептеу арқылы
коэффиценттердің дұрыс екендігін тексеру.
2Al+3H2+1S+6O4-2 =Al2+3(S+6O4-2) 3+3H2
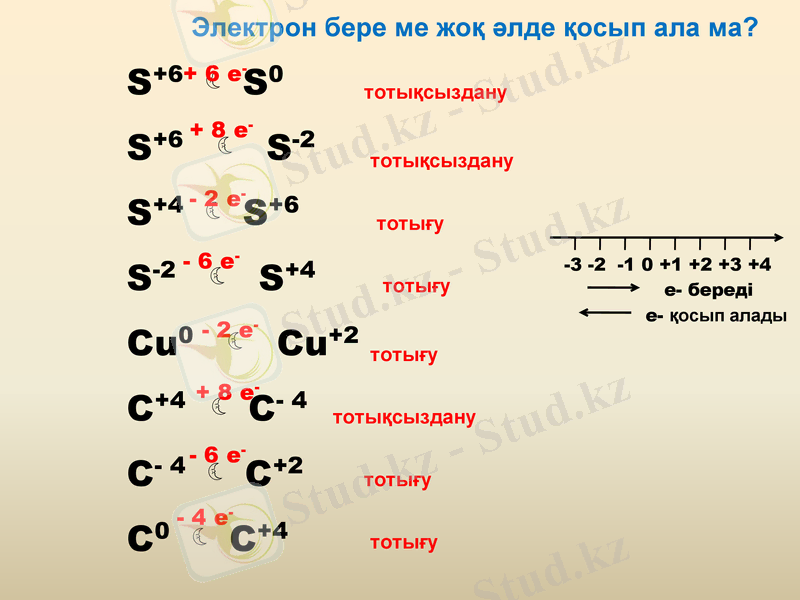
Электрон бере ме жоқ әлде қосып ала ма?
S+6 S0
S+6 S-2
S+4 S+6
S-2 S+4
Cu0 Cu+2
C+4 C- 4
C- 4 C+2
C0 C+4
+ 6 e-
+ 8 e-
- 2 e-
- 6 e-
- 2 e-
+ 8 e-
- 6 e-
- 4 e-
тотықсыздану
тотықсыздану
тотығу
тотығу
тотығу
тотығу
тотығу
тотықсыздану
-3 -2 -1 0 +1 +2 +3 +4
е- береді
е- қосып алады
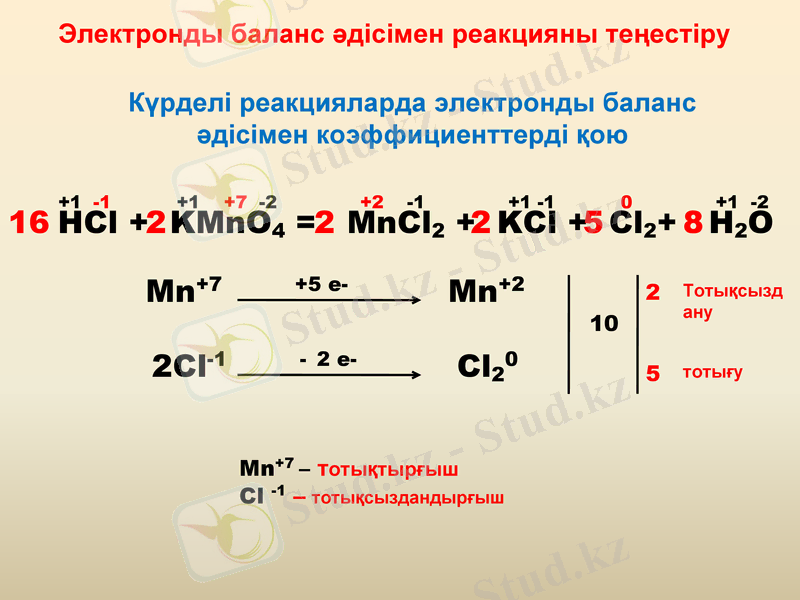
Электронды баланс әдісімен реакцияны теңестіру
Күрделі реакцияларда электронды баланс әдісімен коэффициенттерді қою
HCl + KMnO4 = MnCl2 + KCl + Cl2+ H2O
+1 -1 +1 +7 -2 +2 -1 +1 -1 0 +1 -2
Mn+7 +5 e- Mn+2
2Cl-1 - 2 e- Cl20
10
2
5
2
2
5
2
16
8
Тотықсыздану
тотығу
Mn+7 - тотықтырғыш
Сl -1 - тотықсыздандырғыш

а) Al+ O2 → Al2 O3
Al e → Al
O2 e → O
б) Fe + Cl2 → Fe Cl3
Fe e → Fe
Cl2 ē → Cl
в) Li +S → Li2 S
Li ē →Li
S e →S

а) 4Al0+3O20 →2Al2+3O3-2
Al0 - 3e →Al+3 4 тотығады тотықсыздандырғыш
O20+4e →2O-2 3 тотықсызданады тотықтырғыш
б) 2Fe0 +3Cl20 →2Fe+3Cl3-1
Fe0 -3e →Fe+3 2 тотығады тотықсыздандырғыш
Cl20 +2ē →2Cl-1 3 тотықсызданады тотықтырғыш
в) 2Li0 +S0 →Li2+1S-2
Li0 -1ē →Li+1 2 тотығады тотықсыздандырғыш
S0+2e →S-2 1 тотықсызданады тотықтырғыш

Тотығу тотықсыздану реакциясын жаз.
А. Al + MnO2 = Al2O3 + Mn
Fe2O3 + Zn = ZnO + Fe
B. Mg+H2SO4 = MgSO4 + H2S + H2O
Cu + HNO3 = Cu(NO3) 2+ NO + H2O
C. KI + FeCl3 = l2 + KCl + FeCl2
Cr2O3 + K2CO3 + O2 = K2CrO4 + CO2

«Сәйкестігін тап» ойыны:
Қосылу реакциясы Барлық реагенттер мен өнімнің құрамы өзгеретін реакция
Айырылу реакциясы Бір реагенттің және бір өнімнің құрамы өзгеретін реакция
Орынбасу реакциясы Бірнеше реагент әрекеттесіп, бір өнім түзілетін реакция
Алмасу реакциясы Бір күрделі заттан бірнеше заттар түзілетін реакция
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz