Химиялық термодинамика, кинетика, катализ және хроматография: биологиялық жүйелердегі қолданылуы



Тірі ағзада жүретін процестер -
физикалық-химиялық интерпретация
Дәріскер:
доцент Э. К. Карлова

Химия - түрлі жүйелердегі, соның ішінде тірі ағзадағы да процестерді зерттеу мен түсіну үшін қажетті инструмент болып табылатын іргелі сала.
Тірі ағзада қалыпты жағдайда және патология кезінде болатын құбылыстарды тек қана ондағы жүретін химиялық процестерді зерттеу және бағалау арқылы түсінуге болады, ал емдеу тек қана химиялық құралдардың көмегімен ғана жүзеге асырылады
Парацельс

Термодинамикалық жүйе - қоршаған ортадан шынайы не шартты түрде бөлінген, бір немесе өзара әрекеттесуші бірнеше денелер жиынтығы
Гомогенді жүйе (ауа)
Гетерогенді жүйе (қан)
Химиялық термодинамика - химиялық энергияның басқа бір энергия түріне айналу заңдылықтарын зерттейтін ғылыми сала
Оқшауланған жүйе - қоршаған ортамен энергиясымен де массасымен де алмаспайтын жүйе (m = 0, U = 0) .
Ашық жүйе - қоршаған ортамен энергиясымен де
массасымен де алмасатын жүйе
Жабық жүйе - қоршаған ортамен энергиясымен
алмасып, массасымен алмаспайтын жүйе

Жүйе күйі:
Термодинамикалық тепе-теңдік күйі - уақыт аралығындағы жүйе қасиеттерінің кез-келген нүктедегі тұрақтылығы, энергия және зат алмасу процестерінің болмауы
Стационарлы күйі - қоршаған ортамен үздіксіз энергия көзі мен зат алмасу процестерінің нәтижесінде жүйе қасиеттерінің уақыт аралығындағы тұрақтылығы
Ауыспалы күйі - уақыт аралығындағы жүйе қасиеттерінің өзгерісі

Термодинамикалық тұрғыдан тірі ағза:
стационарлық күйде болатын ашық гетерогенді термодинамикалық жүйе
Тірі ағзаға тән:
Жүйе параметрлерінің тұрақтылығы;
уақыт аралығында қоршаған ортамен энергия көзі мен зат алмасу процестерінің үздіксіздігі

Ішкі энергия (U) -жүйенің жалпы энергия қоры, жүйе бөлшектерінің өзара әрекеттесуі мен қозғалыстарының барлық түрін құрайды
Процесс - жүйенің бір күйден екінші күйге өту барысындағы осы жүйені сипаттайтын кез-келген бір параметрдің қайтымды не қайтымсыз өзгерісі
Биохимиялық реакциялар
р, Т = const
Процестердің жіктелуі:
Изотермиялық (Т = const, T = 0)
Изобаралық (р = const, р = 0)
Изохоралық (V = const, V =0)

Энтальпия (Н) -изобарлы-изотермиялық жағдайдағы жүйенің энергиясын сипаттайтын жүйе күйінің функциясы.
Ол ішкі энергия мен жұмыстың қосындысына тең ΔH = ΔU + pΔV
Энтропия - жүйенің ретсіздігінің сандық мөлшерін көрсететін жүйе күйінің функциясы

Химиялық реакция қай бағытта өздігінен жүру керек?
Өздігінен жүретін процесс - сыртқы факторлардың әсерінсіз жүретін термодинамикалық процесс

Егер процесс кезінде ретсіздік өзгермесе (S = 0), онда процестің бағыты энтальпияның өзгерісімен анықталады және процесс өздігінен энтальпияның кему бағытына қарай жүреді
Егер процесс кезінде энергетикалық өзгерістер болмаса (Н = 0), онда процестің бағыты энтропияның өзгерісімен анықталады және процесс өздігінен ретсіздіктің, яғни, энтропияның арту бағытына қарай жүреді
Жүйенің энергия минимумына ұмтылуы
Жүйенің энтропия максимумына ұмтылуы

Дж. Гиббс
(1839-1903)
Процестердің өздігінен жүру шарты ретінде екі фактордың да (энтальпия және энтропия) әсерін ескеретін жүйе күйінің функциясы - Гиббстің бос энергиясы алынады
G = H - TS
Гиббстің бос энергиясы (G) - жүйенің берілген процесте атқара алатын максималды пайдалы жұмысына абсолюттік мәні жағынан тең, таңбасы жағынан қарама-қарсы болатын термодинамикалық жүйе күйінің функциясы
ΔG = -Amax
Гиббстің бос энергиясы

Процестің өздігінен жүру мүмкіндігінің шарттары:
Процесс өздігінен жүреді
dG<0 (dH<0, dS>0)
Процесс өздігінен жүрмейді
dG>0 (dH>0, dS<0)
Жүйе тепе-теңдік күйде болады
dG=0
Биохимиялық процестер
Экзергоникалық G < 0
Эндергоникалық G > 0

Пригожин принципі:
Стационарлық күйдегі термодинамикалық ашық жүйеде қайтымсыз процестердің жүру барысындағы энтропияның пайда болу жылдамдығының мәні берілген жағдайларда ең аз оң шамаға ұмтылады
∆Si/∆z→0

Химиялық кинетика
химиялық реакциялардың жылдамдығын;
химиялық реакциялардың жүру механизмін;
реакция жылдамдығының түрлі факторларға тәуелділігін
зерттейтін ғылыми сала
Химиялық кинетика
Бастапқы заттар
Реакция өнімдері
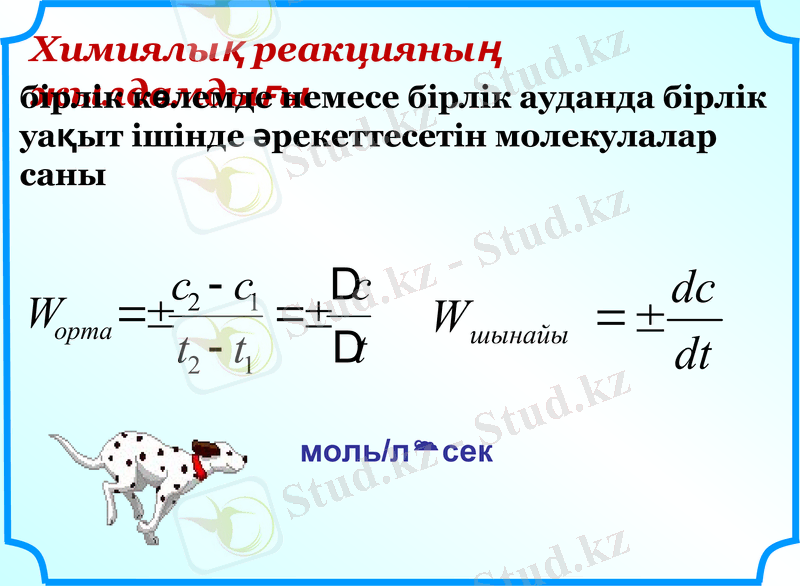
Химиялық реакцияның жылдамдығы
бірлік көлемде немесе бірлік ауданда бірлік уақыт ішінде әрекеттесетін молекулалар саны
моль/лсек

Жәй (бірсатылы) реакциялар
Мономолекулалық
А өнім
I2 2I
Тримолекулалық
2NO(г) + H2(г) N2O(г) + H2O(г)
Бимолекулалық
А + В өнім
NO(г) + O3(г) NO2(г) + O2(г)

Химиялық реакцияның жылдамдығына
әсер етуші факторлар:
әрекеттесуші заттардың табиғаты;
әрекеттесуші заттардың концентрациясы;
температура;
катализатордың қатысы

әрекеттесуші заттардың табиғаты
(молекулалар, иондар, атомдар, радикалдар)
Химиялық реакцияның жылдамдығына
әсер етуші факторлар

Концентрация:
Әрекеттесуші заттар концентрациясының артуымен реакция жылдамдығы артады
Берілген температурада, химиялық реакцияның жылдамдығы, стехиометриялық коэффициенттері дәреже түрінде алынған, әрекеттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал
Реакция жылдамдығына концентрацияның әсері
Массалар әрекеттесуші заңы
aA + bB сС + dD

Массалар әрекеттесуші заңы
n = a + b + d - реакцияның жалпы реті
aA + bB + dD

Вант-Гофф теңдеуі
Температураны әрбір 10 градусқа көтергенде
реакция жылдамдығы 2-4 есе артады
Биореакциялар үшін қолданылмайды
= 7 - 9
Температураның әсері
!

КАТАЛИЗ Оң катализ Теріс катализ
Катализдің негізгі заңдылықтары
Каt тек қана ТД мүмкін реакцияларды ғана жылдамдатады
Еа төмендеуімен W
3. Каt реакцияның тепе-теңдік қалпын бұзбайды, тура және кері реакция жылдамдықтарын бірдей өзгертеді
4. Каt активтілігін арттыруға (промоторлар) немесе бәсеңдетуге (каталит. улар) болады

Ферменттердің катализатор ретіндегі негізгі ерекшеліктері:
Ферментативті катализ
Катализдіің жалпы заңдылықтары сақталынады!
өте жоғары каталитикалық активтілігі;
субстратқа және биохимиялық реакцияға таңдамалы (селективті) түрде әсер ету қасиеті;
температура мен орта рН-ның өзгерісіне ерекше сезімталдығы.

Ферменттердің каталитикалық активтілік көрсету шарттары
Температураның жоғары болмауы;
рН мәндерінің шағын аумағы;
Қысымның тұрақты болуы.
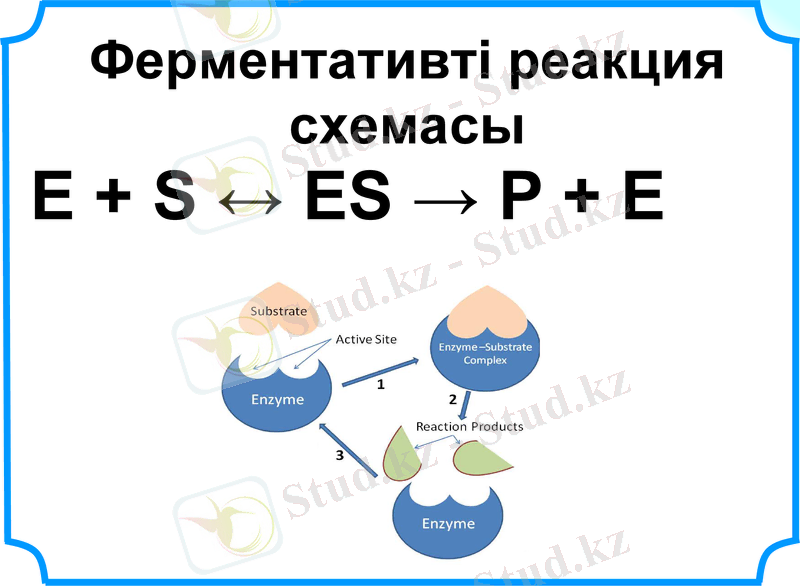
Ферментативті реакция схемасы
Е + S ↔ ЕS → Р + Е

Михаэлис-Ментен теңдеуі
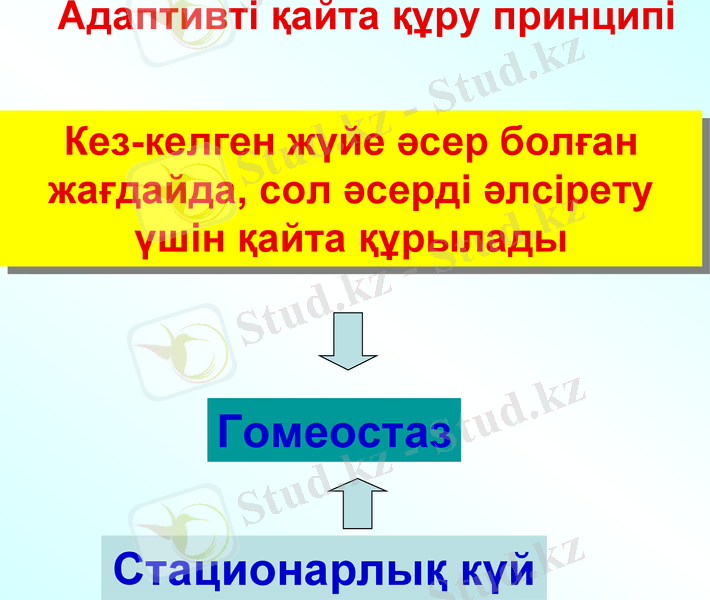
Адаптивті қайта құру принципі
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz