Химиялық реакциялардың кинетикалық жіктелуі, катализ және ферменттік катализ: ферменттердің әсер ету механизмдері мен организмдегі рөлі



Тақырыбы: Химиялық реакциялардың кинетикалық жіктелуі. Ферментті катализ. Катализдің организмнің тіршілігіндегі рөлі.
Орындаған: Бектемирова Сабира
Топ: Медицина 108 Б
Тексерген: Жиенбаева Л. Б.
СӨЖ
Қазақстан-Ресей Медициналық университет

Жоспар
• Кіріспе • Негізгі бөлім 1. Химиялық реакциялардың кинетикалық жіктелуі. 2. Катализ. 3. Ферментті катализ 4. Ферменттердің әсер ету механизмдері. • Қорытынды • Пайдаланылган әдебиеттер.

1) Химиялық реакциялардың кинетикалық жіктелуі.
• Химиялық кинетика-химиялық реакцияның жылдамдығын және oған әртүрлi факторлардың әcepiн, реакцияның журу механизмiн зерттейдi. • Химиялық реакцияның жылдамдығы дегенiмiз белгiлi бiр уақытта әрекеттесетiн заттар мелшерiнiң Өзгеруiн айтады. Мыс: белгiлi бiр уақыт аралығында болғанда, әрекеттесушi заттардың концентрациясы да өзгередi, яғни кемидi: Сонда химиялық реакцияның орташа жылдамдығы уақыт аралығында тең болады. • Теңдеудiң сол жағындағы (-) белгi, химиялық реакция барысында әрекеттесушi заттардың концентрациясының кемитiндiгiн, cоғaн орай реакция жылдамдығының баяулайтындығын керсетедi.

Химиялық реакциялардың кинетикалық жіктелуі.
Әрекеттесушi заттардьң концентрациясын, әдeттe ерiтiндiнiң белгiлi бiр келемiнде epiген заттың моль санымен керсетедi (моль/л), ал уақытты сек. Не мин. керсетедi. Химиялық реакция жылдамдығынмреакцияға қатысушы заттардыц бiрiнiң концентрациясының азаюы аркылыда керсетуге болады Реакцияның орташа жышдамдығын әрекеттесушi заттың концентрациясының шексiз езгеруiнiн ең шексiз кiшкене yaқыт аралығына қатынасы өлшемiмен керсетедi: Химиялық реакция жылдамдығын реакцияға қатысқан заттардың табиғатына, (ерiткiштiң табиғатына) реагенттердiң концентрациясына, температураға және катализатордың қатысу қатыспауына тiкелей тәуелдi болады. Реакцияға қатысатын заттардың агрегаттық куйiне байланысты химиялық реакция гомогендiк және гетерогендiк болып екі топқа бөлiнедi. Әрекеттесетiн және түзiлетiн заттар бiрдей агрегаттьқ күйде болатын химиялық реакцияны гомогендiк деп, ал қатысатын не түзiлетiн заттардың агрегаттық куйi әр түрлi болатын реакцияны гетерогендiк деп атайды.

Химиялық реакциялардың кинетикалық жіктелуі.
• Гомогендiк реакция, гетерогендiк реакцияға қарағанда жылдамырақ журедi. Гетерогендiк реакцияныц жылдамдығы әрекеттесушi заттардыңжанасу беткейiнiң көлемiне, дисперсиялық дәрежесiне тiкелей байланысты. Егер әрекеттесушi заттар газ куйiнде болса, химиялық реакцияның жылдамдығы қысымға тiкелей байланысты болады, себебi қысымның езгеруiне байланысты әрекеттесушi заттардыц концентрациясы да езгередi. Әрекеттесушi заттардың концентрациясы химиялық реакция жылдамдығына қалай әcep етедi? • Химиялық реакция журу ушiн әрекеттесушi заттардың молекулаларыбiрiмен-бiрi соқтығысулары қажет. Бiрақ әрбiр соқтығысқан сайын бөлшектер әрекеттece бермейдi.

Химиялық реакциялардың кинетикалық жіктелуі.
• Белгiлi бiр келемде белшектердiң, молекулаларының саны неғұрлым көп болса, соғұрлым әpeкeттecy нәтижелi болады. Коновалов және 1864 жылы норвег ғалымдары К. Гулъберг пен П. Baaгeннің; ашқанан әрекеттесушi массалар заңы бойынша «Тұрақты температурадағы химиялык реакцияның жылдамдығы, стехиометриялық коэффиценттерi дәреже керсеткiш турiнде әрекеттесушi заттардың концентрацияларының кебейтiндiсiне тура пропорционалдық тәуелдiлiкте болады». Мыс: мына схема бойынша журетiн яғни А-В типтi мономолекулалық реакциялардың жълдамдығы төмендегiдей кинетикалық тендеумен керсетiледi:V=K [А] =К. [А] немесе V=кСл=КСл[А] не СА - А затының сол кезендегi концентрациясы; К жылдамдықконстантасы, егер А затының концентрациясы [А] = lмолъ·л болса, V = К болады. К-А затының табиғатына, температураға, катализатордың қатысуына тәуелдi болады да, концентрациясына тәуелсiз болады. Жылдамдық константасы неғұрлым көп болса, реакция жътлдамдығы соғұрлым тезiрек болады.

Катализ
• Химиялық езгерiстердiң маңызды реттегiшi катализаторлар болып табылады. Катализаторлар реакция компоненттерiмен аралық химиялық әрекеттесуге бiрнеше рет катысып, құрамын сол күйiнде сақтап қалуы нәтижесінде химиялық реакция жылдамдығын езгертетін заттар. • Катализатор кызметi берiлген реакцияның активтендiру энергиясынтемендетiп, оның жаңа тиiмдi жолмен жүруiн қамтамасыз етедi. • Егер А + В → АВ реакциясы Еа активтендiру энергиясын иемденсе (сурет 1), онда катализатор (к) аралық өнім А + К → AК түзуi арқылы Еа шамасын темендетедi. Онда АК комплекс В компонентпен әрекеттеседi. Бұл реакция Еа салыстырғанда активтендiру энергиясы төмен жағдайда журедi. Сонымен, әрекеттесудiң қосындысы нәтижесiнде АВ өнімі түзiлдi, ал катализатор реакциядан езгерiссiз қалады.
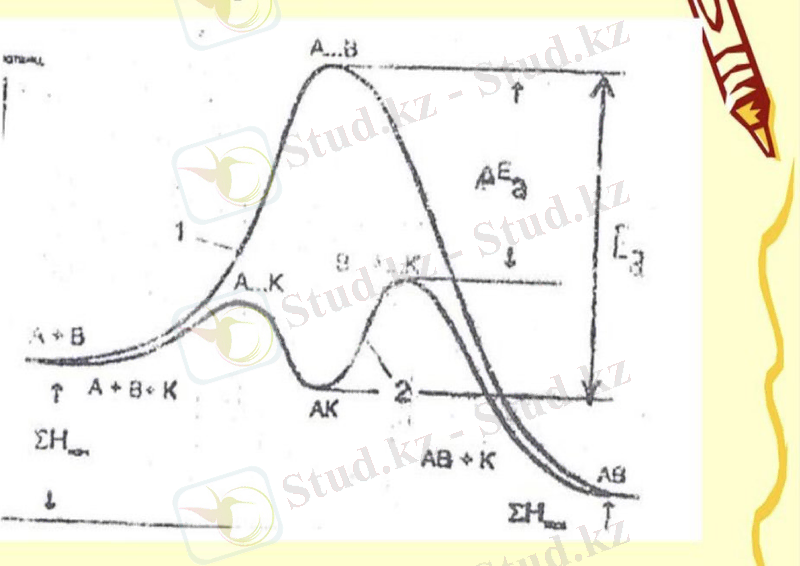

1-сурет. Катализатордың әcep eтyiнің энергетикалық диаграммасы.
Суреттен көрiнiп тұрғандай, Еа шамасын аз өзгерткеннiңөзi процесс жылдамдығын арттырады. Ол катализатордың үлкеншектi мәні бар eкенін көрсетедi.

Катализ eкiгe бөлiнедi 1) оң (реакция жылдамдығы артады) 2) теріс(реакция аз жылдамдықпен өтедi) .
• Соңғы катализдiң тypін ингибирлеу деп атайды. Ингибиторлер практикада консерванттар, антиоксиданттар және т. б. ретiнде қолданылады. Ингбирлеу оң катализ сияқты биопроцестердiң жылдамдықтарын реттеу ушiн қажет. • Егер реакция нәтижесiнде түзiлген өнім жылдамдыққа әcep етсе, оны автокатализ деп атайды. Автокатализ мысалына КМn04 тотығyын келтiредi, оның жылдамдығының артуы реакциялық ортада жүрген катионының әсерінен жүзеге асады.

Катализ бөлінеді: 1) Гомогенді 2) Гетерогенді
• Гомогендi катализде катализатормен реакцияға қатысатын заттар бiртектi жүйе түзедi (әдeттe сұйық немесе газды) . Мысалы, СОның СО2 дейiн тотыry су буының әcepiнен жүредi. • Гетерогендi катализде катализатор реакцияға түceтiн заттардан бөлек фаза кұрайды да, каталитикалық процесс жүйенiң бөлiну шекарасында өтедi. Гетерогендi катализаторлар ретiнде металдар және олардың оксидтерi және т. б. пайдаланылады. Гетерогендi катализдiц теориясы ете күрделi . • Катализде микрогетерогендi катализ ерекше орын алады, онда катализатор коллоидты немесе жоғары молекулалық күйде болады. Мысалы ретiнде биокатализатор-ферменттердiң әcepiнeн жүретiн барлық биопроцестердi келтiруге болады .

3) Ферментті катализ
Ферменттер ағзада журетiн химиялық реакциялардың катализаторлары болып табылады. қазiргi кезде 1 жуық биохимиялық реакция белгiлi, олардың әрқайсысы ферменттердiң қатысуында жузеге асырылады. Ферменттердiң ерекше қасиетi - жоғарғы тиiмдiлiriнде. Мысалы, сутектiң aсқын тотығyының ыдырауы катализаторсыз активтендiру энергиясы 75 кДж/моль, гетерогендi катализде платинаның әcepiненактивтендiру энергиясы 48 кДж/мольге дейiн төмендейдi, ал фермент-каталазаның қатысуында активтендiру энергиясының шамасы небарi 23 кДж/мольге ие болады. Мұндай активтендiру энергиясының езгерiсi реакция жылдамдығын 20 000 және 3-1011 есе арттыруға әкелiп соқтыpaды. Aқсыл заттардың НСl әcepiнeн гидролизге ұшыpayы ушiн активтендiру энергиясы 80 кДж/моль болу кажет, ал ақазан сөлiнде кездесетiн фермент трипсиннiң қатысуында оның шамасы 50 кДж/моль болады, сөйтiп асқазанның ақсыл затты, тағамды сіңіруі іске асырылады.

Ферментті катализ
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz