Біртекті жүйедегі химиялық тепе-теңдік: ерітінділер, электролиттік диссоциация, иондану және рН есептері



№4-5 дәрістің тақырыбы:
Біртекті жүйедегі химиялық тепе-теңдік

Жоспары
Химиялық жүйелер. Ерітінділер.
Электролиттік диссоциация теориясы.
Иондану дәрежесін анықтау. Әлсіз электролиттердің иондану константасы мен иондану дәрежесі арасындағы байланыс.
Күшті электролиттер теориясының негізгі жағдайлары
Судың диссоциациясы. Сутектік көрсеткіш.
Ерітінділердің рН және рОН анықтау.
Буферлі ерітінділердің рН есептеу

Кіріспе
Аналитикалық химиядағы сапалық және сандық талдау әдістері ерітінділерге реакцияларға негізделген. Табиғатта, технологиялық процестерде металлдарды алу, тұз және қышқылды алу т. б. ерітінділерде жүреді.
Белгілі бір физика-химиялық процесте болатын немесе процеске қатысатын заттардың жиынтығын жүйе д. а.
Гомогенді жүйе - құрамы мен қасиеттері жағынан жүйе компоненттері бір-бірінен ажырамайтын, бөлінбейтін біртекті жүйе (газ қоспасы, негіздер, тұздар ерітінділері) .
Гетерогенді жүйе - бір - бірінен жекеленетін бөлімдерге ажыратушы беттері бар, құрамы мен қасиеттерінің әркелкілігімен сипатталатын жүйе(май - су, қаныққан ерітінді т. б. ) .

Ерітінділер
Ерітінділер дегеніміз екі немесе одан да көп компоненттерден тұратын біртекті жүйе.
Еру процесі -күрделі физика-химиялық процесс, еритін зат пен еріткіш бөлшектерінің арасында өзара әрекеттесу болады.
Еріткіштің еріген зат бөлшектерімен әрекеттесу нәтижесінде сольваттар, ал сулы ерітінділер өнімдері гидраттар д. а.
Әр түрлі заттар еріткіштерде әр түрлі мөлшерде ериді.
Ерігіштік - заттың суда немесе басқа еріткіште еруі, яғни белгілі температурада 100 г еріткіштегі еритін заттың массасы.

Электролиттік диссоциация теориясы
Барлық заттар электролиттер және бейэлектролиттер (электролит емес) болып жіктеледі.
Электролиттер еріген кезде иондарға дейін бөлшектенеді және олардың ерітінділері немесе балқымалары электр тоғын өткізеді. Электролиттерге негіздер, қышқылдар, тұздар жатады.
Бейэлектролиттер еріген кезде тек молекулаларға дейін бөлшектенеді және олардың ерітінділері де балқымалары да электр тоғын өткізбейді.
Электролит еместерге көптеген органикалық қосылыстар (қант, глюкоза, спирт) жатады.
Электролиттер дегеніміз электр тоғын өткізгенде ерітінділер мен балқымалардағы заттардың иондарға ыдырауы.
Электролиттік диссоциация процесінің жүзеге асуының негізгі шарты еріген заттарда иондар мен полярлы байланыстың болуы және еріткіш молекуласының полюсті болуында (иондық және полюсті ковалентті байланысы бар заттар) .

Сванте Аррениустың электролиттік диссоциация теориясы
- электролиттер суда еріген кезде оң және
теріс иондарға ыдырайды (диссоциацияланады)
- электр тогы әсерінен оң зарядталған иондар
катодқа (-) тартылады, оларды катиондар деп атайды,
теріс зарядталған иондар анодқа (+) тартылады, оларды аниондар деп аталады;
- диссоциация - қайтымды процесс, ыдыраумен қатар иондардың қосылуы процесі жүреді.
Электролиттік диссоциациялануды химиялық теңдеу арқылы өрнектейді:
КА ↔ К+ + А-
Мысалы: НCl = H+ + Cl-

Диссоциациялану дәрежесі
Св. Аррениус ерітіндіде электролиттің қандай да бір бөлігі диссоциацияланатын болғандықтан, электролиттердің диссоциациялану дәрежесі деген ұғымын ұсынды.
Иондарға ыдыраған молекулалар санының ерітуге алынған электролит молекулаларының жалпы санына қатынасы электролиттің диссоциациялану дәрежесі деп аталады.
Диссоциациялану дәрежесіне келесі факторлар әсер етеді: еріген заттар мен еріткіш табиғаты, температура, ерітінді концентрациясы және аттас иондардың әсері.
Диссоциациялану дәрежесіне байланысты әлсіз және күшті электролиттер болып бөлінеді
Әлсіз
Күші орташа
Күшті
< 3%
3%<<30%
>30%
Cu(OH) 2, Fe(OH) 3, AІ(OH) 3, Cr(OH) 3 суда ерімейтін тұздар мен негіздер
H3PO4 H2SO3, HF,
Fe(OH) 2, Ве(OH) 2, АІ(ОН) 3
суда аз еритін тұздар
LIOH, КOH, NaOH, CsOH, H2SO4, HCI, HNO3 HCIO3, HCIO4, HBr, HІ
суда жақсы еритін тұздар

Диссоциациялану костантасы
Әлсіз электролит ерітіндісінде молекулалар мен иондар арасында орнаған тепе-теңдіктің константасын жазуға болады. Мысалы
CH3COOН = Н+ + CH3COO-
К = [H+] [CH3COO-] / [CH3COOH]
Әлсіз электролиттің диссоциациясын көрсететін тепе-теңдік константасы диссоциациялану костантасы деп аталады. К мәні электролит пен еріткіштің табиғатына және температураға тәуелді болады, ерітінді концентрациясына тәуелді емес.
Көп негізді қышқылдар сатылап диссоциацияланады. Мысалы:
H2CO3 ↔ H+ + HCO3- К1 = [H+] [HCO3-] / [H2CO3]
HCO3- ↔ H+ + CO32- К2 = [H+] [CO32] / [HCO3-]
Жалпы тепе-теңдік: H2CO3 ↔ 2H+ + CO32-
Заттар сатылай диссоциацияланғанда келесі саты бойынша ыдырау алғашқы сатыға қарағанда үнемі төменірек жүреді (бірінші сатыға қарағанда екінші саты аз) .
К1 > К2 > К3 . . .

Диссоциациялану константасы
Әлсіз электролиттің иондарға ыдырау қабілеттілігін көрсетеді

Оствальдтың сұйылту заңы
Диссоциация константасы К, диссоциациялану дәрежесі және концентрация С арасындағы байланыс:
егер электролит 2 ионға ыдыраса, оның диссоциациялану дәрежесі әрбір ионның концентрациясы с, диссоциацияланбаған молекулалар с - с немесе с(1-) белгілеуге болады. Осы мәндерді теңдеуге қойса, диссоциациялану константасы былай түрленеді:
Кдис = (с ·) 2 / с(1 - ) немесе Кдис 2 · с / 1-
бұл теңдеу Оствальдтың сұйылту заңы деп аталады.
Электролит диссоциациясы өте төмен ерітінділер үшін, Оствальд теңдеуін ықшамдауға болады, яғни <<1 болса, ол шаманы ескермеуге болады, онда теңдеу келесі түрге келеді :
Кдис 2 · с
Сонымен ерітіндіні сұйылтқан сайын диссоциациялану дәрежесі артады .

Жаттығу орындау
0, 01М сірке қышқылының иондану дәрежесі 4, 19%. Қышқылдың иондану константасын есептеңіз.
Шешуі. Сірке қышқылының иондану константасын келесі формуламен есептейді.
Кион = сα2
Есептеу жүргізуде иондану дәрежесі өлшемсіз шамасына көшіріледі:
αион = 4, 19 : 100% = 4, 19 . 10-2
Иондану константасы келесі формула бойынша есептеледі:
К = 0, 01 . (4, 19 . 10-2) 2 = 1, 75 . 10-5

2- жаттығу
Бер. Диссоциациялану дәрежесі 0, 042 тең 0, 01 н сірке қышқылы ерітіндісінің сутегі ионының концентрациясын есептеңіз.
Шешуі:
Бір негізді сірке қышқылының молярлы және нормалды концентрацияларын бірдей:
См = Сн = 0, 01 М
СН3СООН → СН3СОО- + Н+
1 моль 1 моль 1моль
Диссоциациялану дәрежесінің формуласы бойынша
αион = [Н+] / С
[Н+] = С . αион = 0, 01 . 0, 042 = 0, 00042 = 4, 2 10-4
Жауабы: 4, 2 10-4

Күшті электролиттер теориясы
Әлсіз электролиттер ерітінділерде ионаралық элекростатикалық күштердің әсерінен олардың концентрациясы аз болғандықтан ескермеуге болады.
Күшті электролиттердің концентрациясы дәл осындай болғанда иондар концентрациясы әлдеқайда жоғары, олардың арасындағы әрекеттесулер елеулі бола бастайды және соған сәйкес күшті электролит диссоциациясы әсер етушілер массасынан ауытқиды. Сондықтан күшті электролиттер теориясын 1923ж. Дебай - Хюккель түсіндірді. Негізгі жағдайлары:
1. Күшті электролиттер ерітіндіде 100 % диссоциацияланады (жылу эффектін өлшеу және спектральды анализ) .
2. Күшті электролиттер диссоциация арқылы түзілген иондардың арасында өзара тартылу күші пайда болады. Осы иондар арасындағы күшті әрекеттесуші массалар заңына бағынбауына әкеледі.
Күшті электролиттер тәжірибе жүзінде анықталған tқайнау жоғарылауы, tқату төмендеуі, осмос қысымының сандық мәндері олардың толық иондарға ыдырағанда көрсетуге тиісті мәндерінен біраз төмен екенін көрсетті.

Активтілік
Күшті электролиттердің химиялық реакцияға түсу қабілеттілігін бағалау үшін «активтілік» деген түсінік енгізілді.
Активтілік деп химиялық реакция кезінде әсерлесетін нақты, эффективті концентрациясын айтады.
Активтілік пен ионның нағыз концентрациясы арасындағы тәуелділік келесі формуламен сипатталады:
а = f с
мұндағы а - активтілік, f - активтілік коэффициенті, с - концентрация.
Ионның активтілігін ескере отырып анықталатын иондану константасы ионданудың термодинамикалық константасы деп аталады.
Ка= аKt aAn / aKtAn

Активтілік коэффициенті
Басқа иондар қатысында иондардың активтілігі ерітіндінің иондық күшіне тәуелді, ол ерітіндідегі барлық иондардың заряды мен концентрациясына байланысты. Иондық күш төмендегі формула бойынша есептеледі:
І = 1/2 Σ cnzn2 немесе І = 1/2(с1z12 + c2z22 + c3z32 + . . . + cnzn2)
мұндағы с1, c2, c3 немесе сп - иондардың молярлы концентрациясы,
z12, z22, z32 немесе zn2 - иондардың зарядтарының квадраты.
Активтілік коэффициенті ерітіндінің иондық күшіне байланысты, бұл тәуелділік Дебай және Хюккель формуласымен анықталады:
І ≤ 0, 01 болған жағдайда, lg f = - 0, 5 Z2 . √ І
0, 01 ≤ І < 0, 1 болған жағдайда, lg f = - 0, 5 Z2 . √ І / 1 + √ І

Иондық күшті есептеу
1- есеп.
Бер: Концентрациясы 0, 02 моль/л натрий фосфаты ерітіндісінің иондық күшін
есептеңіз.
Шешуі
1) Na3РO4 күшті электролит, сондықтан иондарға толық ыдырайды:
Na3РO4 → 3Na + + РO4 2-
2) Иондардың концентрациясы:
СNa + = 3 . 0, 02 = 0, 06 моль/л
С(РO4 3- ) = 0, 02 моль/л
3) Ерітіндінің иондық күші төмендегі теңдеумен анықталады:
І = ½Σ с1z12
І = ½( СNa + . z 2 Na + + С(РO4 3- ) . z2(РO4 3- ) = ½ (0, 06 . 12 + 0, 02 . (- 3) 2 = 0, 12
Жауабы 0, 12

Жаттығу орындау
Есеп. Концентрациясы 0, 004 моль/л магний нитраты ерітіндісіндегі иондардың активтік коэффициенті мен концентрацияларын есептеңіз.
Шешуі
1) Mg(NO3) 2 күшті электролит, сондықтан иондарға толық ыдырайды:
Mg(NO3) 2 → Mg 2+ + 2NO3-
Иондардың концентрациясы:
СMg 2+ = 0, 004 моль/л
С(NO3- ) = 2 . 0, 004 = 0, 008 моль/л
Ерітіндінің иондық күшін есептейді:
І = ½( СMg 2+ . z2 Mg 2+ + С NO3-. z2NO3-) = ½ (0, 004 . 22 + 0, 008 . (-1) 2 ) = 0, 012
Ерітіндінің І > 0, 01 болғандықтан, келесі формуланы қолданылады:
lg f Mg 2+ = -0, 5 . 22 √ 0, 012 / (1+ √ 0, 012) = - 0, 198
f Mg 2+ = 0, 634
lg (NO3-) = -0, 5 . 12 √ 0, 012 / (1+ √ 0, 012) = - 0, 050
f (NO3-) = 0, 891
Ерітінділдегі иондардың активті концентрациялары есептеледі:
а = f с
а Mg 2+ = f Mg2+ . С Mg2+ = 0, 634 . 0, 004 = 2, 5 . 10 -3 моль/л
а (NO3-) = f (NO3-) . С (NO3-) = 0, 891 . 0, 008 = 7, 1 . 10 -3 моль/л

Судың диссоциациясы
Таза су электр тогын өте нашар өткізеді, тек сутек иондары мен гидроксид
иондарына азғана мөлшерде диссоциацияланады.
Судың диссоциациялану константасы:
2Н2О ↔ H3О+ + OH- немесе Н2О ↔ H+ + OH-
Қайтымды процес болғандықтан, әрекеттесуші массалар заңын пайдаланып,
диссоциация константасын жазуға болады:
К = [H+] . [OH-] / [H2O]
Бұл теңдеуді төмендегідей жазуға болады:
К × [H2O] = [H+] . [OH-]
Екі тұрақты шаманың көбейтіндісі Ксу = [H2O] . К жаңа константаға алмастырса, келесі формула алынады:
Ксу = [H+] . [OH-]
Бұл тұрақты шама судың иондық көбейтіндісі деп аталады.
Ксу = [H2O] . К теңдеуіне сан мәндерін Кдис = 1, 8 . 10-16 қойғанда,
келесі шама алынады: Ксу = [H2O] . К = 55, 5 . 1, 8 10-16 = 10-14
Ксу = [H+] . [OH-] = 10-14
Су - бейтарап зат. Сондықтан сутек және гидроксид иондарының концентрациялары бірдей, әрқайсысы 10-7г-ион/л тең.

Сутектік көрсеткіш
Ерітіндінің қышқылдығын не сілтілігін ыңғайлы тәсілмен өрнектеу ұсынылған (теріс мәнді көрсеткіші бар сандармен жұмыс жасау ыңғайсыз) оларды сутек иондарының, немесе гидроксид иондарының теріс таңбамен алынған ондық логарифмдерімен көрсетеді. Ол сутек немесе гидроксил көрсеткіші деп аталып, рН және рОН арқылы белгіленеді:
рН = − lg [H+]
рОН = − lg [ОH-]
Теріс таңбамен алынған сутегі ионы концентрациясының ондық логарифмі сутектік көрсеткіш деп аталады.
Теріс таңбамен алынған гидроксил ионы концентрациясының ондық логарифмі гидроксил көрсеткіші деп аталады.
Сонымен, бейтарап ерітіндіде рН = 7 болады,
қышқыл ерітіндіде рН < 7,
сілтілі ерітіндіде рН > 7 тең,
рН + рОН = 14 тұрақты болады.
Мысалы, егер [H+] = 10-3моль/л болса, онда рН= − lg [H+] =− lg [10-3] = 3;
егер [H+] = 10-10 моль/л болса, онда рН= − lg [H+] =− lg [10-10] = 10

рН көрсеткіш
Ерітіндінің рН-ын білу химиялық зерттеу жұмыстарында, әр түрлі өндірістік процестерде, тірі организмдерде жүретін құбылыстарды түсіндіруде аса қажет.
Көпшілік жағдайларда рН-тің дәл мәнін емес, ерітіндінің реакциясының (ортасы) қышқыл немесе сілтілік екендігін сапалық түрде білу жеткілікті, ол үшін индикатор деп аталатын арнаулы реактивтерді қолданады. Индикаторлар сутегі не гидроксид иондары концентрациясына байланысты түстерін өзгертеді.
Жиі қолданылатын индикаторлар: фенолфталеин, лакмус, метилқызғылт, метилқызыл.
Ғылыми зерттеуде, өндірістерде арнайы рН метр деп аталатын аспаптармен анықтайды.
Өсімдік, жануар және адам ағзасында жүретін реакциялар белгілі ортада жүреді.
Мысалы, асқазан сөлінің рН = 1, 7; жауын суында рН = 6, 5 т. б.
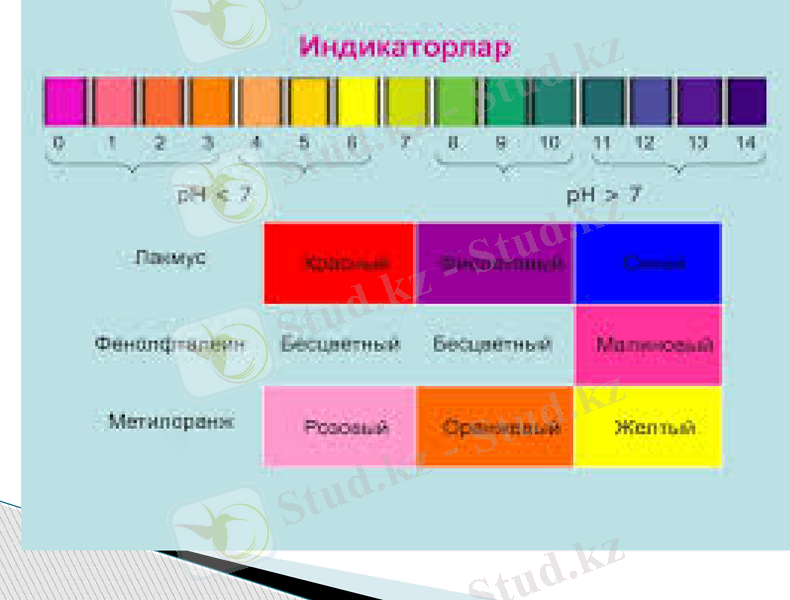

Ерітінділердің рН және рОН анықтау
1) Бірнегізді күшті қышқылдың сутегі ионының [Н +] концентрациясын есептеу
Бірнегізді күшті қышқылдар толық дерлік диссоциацияланады: НА = Н+ + А-
[Н +] = Сқыш, яғни рН= - lg[Н + ]
2) Бірнегізді әлсіз қышқылдың сутегі ионының [Н +] концентрациясын есептеу
Бірнегізді әлсіз қышқылдар диссоциацияланады: НА = Н+ + А- ;
диссоциациялану константасы Кқыш = [Н +] . [А-] / [НА]
Диссоциацияланған молекулаларды [Н +] = [А-] = х, диссоциацияланбаған
молекулаларды [НА] = Сқыш - х деп белгілеп, диссоциацияланған молекулалар
санының диссоциацияланбаған молекулаларға қарағанда өте аз екенін ескере
отырып, Сқыш - х =Сқыш деп қабылдаса, төмендегі теңдеу алынады.
Кқыш = х2 / Сқыш, осыдан х = √ Кқыш . Сқыш немесе
[Н+ ] = √ Кқыш . Сқыш
3) Негіз ерітінділеріндегі гидроксил ионының [ОН -] концентрациясын есептеу
Күшті негіз [ОН -] концентрациясы сілтінің концентрациясына тең, сондықтан
келесі формуламен есептейді:
[ОН -] = Снег, рОН = -lg [ОН¯] ; рН = 14 - рОН
4) Әлсіз негіздің гидроксил ионының концентрациясын келесі
формуламен есептейді: [ОН- ] = √ Кнег . Снег

Буферлі ерітінділер
Сутегі ионы концентрациясының табиғатта жүретін құбылыстар мен процестер үшін маңызы зор. Көптеген химиялық процестер тек белгілі бір ортада жүреді. Ерітінділердің рН тұрақты етіп тұратын реттегіш заттар бар. Өндірісте, техникада рН-ты тұрақты ету үшін арнайы әзірленген буферлі ерітінділер пайдаланады.
Сапалық және сандық талдауда кейбір талдауларды жүргізуде белгілі рН мәнінде реакция ортасын ұстап тұру қажет болады. Осы мақсатта буферлі ерітінділер қолданылады.
Қышқылды және сілтіні белгілі бір шамаға дейін қосқанда, яғни сұйылту және қойылту кезінде сутегі ионының концентрациясы тұрақты болатын немесе өте аз мөлшерде өзгеретін ерітінділерді буферлі ерітінділер деп аталады.
Бұл ерітінділердің осы қасиеті енгізілген сутегі және гидроксил-иондарының буферлі жүйенің компонентімен аз ионданатын қосылысқа (әлсіз электролитке) байланысуына негізделген.
Буферлі ерітінділерді дайындау үшін әлсіз қышқыл немесе әлсіз негіз бен олардың тұздарының қоспасын пайдаланады.
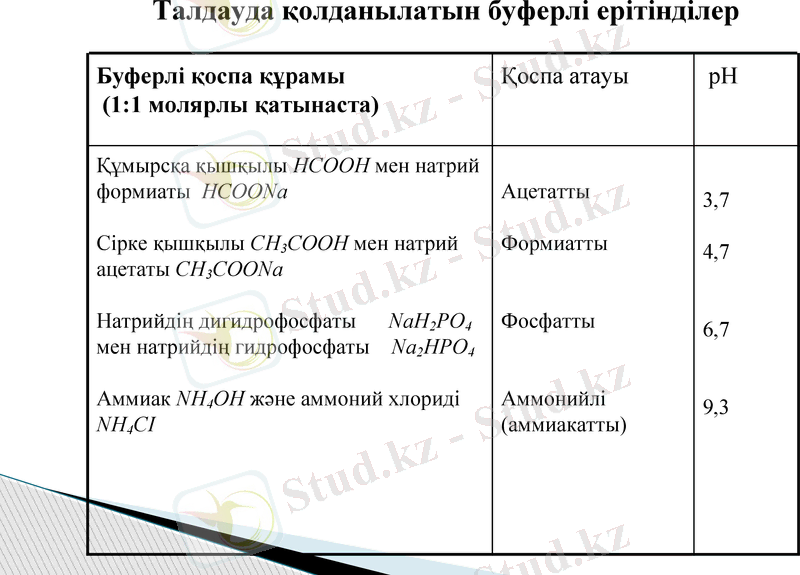
Талдауда қолданылатын буферлі ерітінділер
Буферлі қоспа құрамы
(1:1 молярлы қатынаста)
Қоспа атауы
рН
Құмырсқа қышқылы НСООН мен натрий формиаты НСООNа
Сірке қышқылы СН3СООН мен натрий ацетаты СН3СООNа
Натрийдің дигидрофосфаты NаН2РО4 мен натрийдің гидрофосфаты Nа2НРО4
Аммиак NН4ОН және аммоний хлориді NН4СІ
Ацетатты
Формиатты
Фосфатты
Аммонийлі (аммиакатты)
3, 7
4, 7
6, 7
9, 3

Буферлі ерітінділердің әсері олардың қоспаларының иондары немесе молекулалары қосылатын қышқылдың немесе сілтінің Н+ және ОН¯ ионымен әлсіз электролиттер түзу арқылы байланысады.
1) ацетатты буферлі ерітінді CH3COOH + CH3COONa pH = 3, 7
HCl қосқанда CH3COONa + НСl = CH3COOH + NaCl
CH3COO¯ + H+ = CH3COOH
CH3COO¯иондары Н иондарымен байланысып, әлсіз электролит CH3COOH түзіледі.
2) аммиакты буфер ерітінді NH4OH + NH4Cl pH=9, 3
Сілті қосқанда NH4Cl + NaОН = NH4OH + NaСІ
NH4+ + ОН ¯ = NH4OH
ОН¯және NH4+ ионы әрекеттесіп әлсіз электролит
NH4OH түзеді.

Әлсіз қышқыл мен оның тұздарынан түзілген буферлі ерітінділердің рН есептеу
CH3 COOH және CH3 COONa CH3COOH = CH3 COO¯+ Н +
[CH3 COO¯] [Н +] [CH3COOH]
Кқыш = [Н + ] = Кқыш
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz