Химиялық байланыстың табиғаты: иондық, коваленттік, сутектік және металдық байланыстар



Химиялық байланыстың табиғаты
Орындаған:Амитова Н
БҚБ-301

Жоспар:
Химиялық байланыстардың түрлері
Иондық байланыс
Ковалентті байланыс
Сутектік байланыс
Металдық байланыс

Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды.
Атомдардың электрондық құрылымы анағұрлым тұрақты болған жағдайда ғана химиялық байланыс түзіледі.
Химиялық байланыс түзілуде ең басты рольді электрондар атқарады.

Сыртқы электрондық қабаты ns2np6 типті болған жағдайда электронды октет және 1 s2 аяқталған, анағұрлым тұрақты болады.
Басқа элементтің атомдары химиялық байланыс түзу кезінде осындай электрондық құрылым түзуге ұмтылады. Атомдар арасында тұрақты (аяқталған) электрондық құрылымда болатын ең маңызды екі түрлі химиялық байланыстың түрі иондық (электровалентті) және ковалентті байланыс бар.

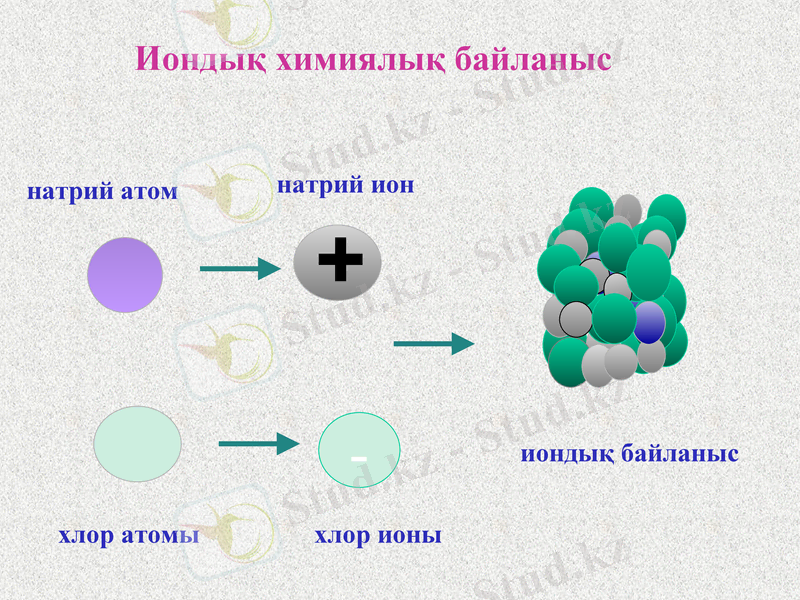
Иондық химиялық байланыс электртерістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі.
Иондық химиялық байланыс қарама -қарсы зарядталған иондардың электростатикалық тартылысы нәтижесінде жүзеге асады.
Иондық байланыс

Иондық байланыс теориясын 1916 жылы неміс ғалымы
В. Коссель ұсынған болатын. Бұл теория типтік металдар мен типтік бейметалдар атомдары арасында: CsF, CsCl, NaCl, KF, KCl, Na2O, CaO түзілетін байланысты түсіндіреді. Осы теорияға байланысты иондық байланыстың түзілу кезінде типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды қосып алады.
КОССЕЛЬ (Kossel),
Вальтер
1888 - 1956 ж. ж.


Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
+
натрий атом


Ковалентті байланыс - бұл атомдар арасында ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыс.
Ковалентті байланыс
Ковалентті химиялық байланыста электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.

Джильбер Льюис

Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасады. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.

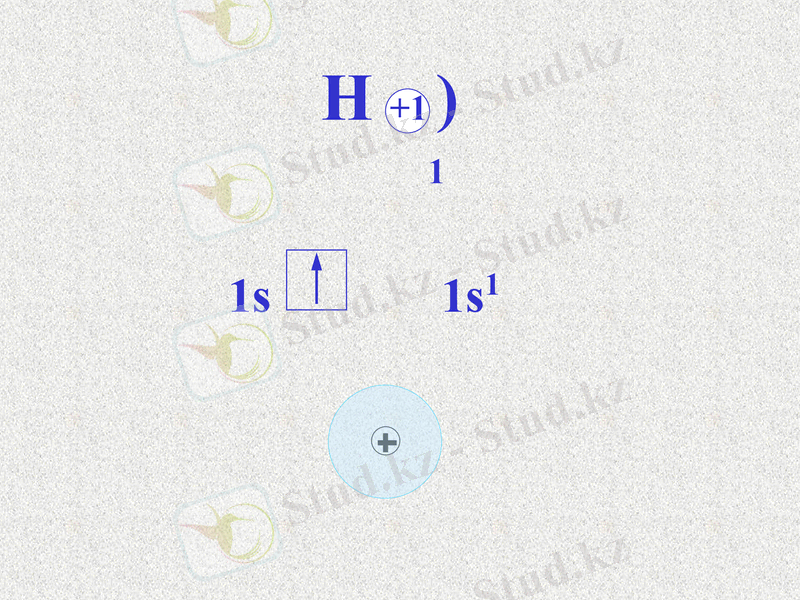
Сутек атомының электрондық формуласы 1s1.
Сутектің электртерістілігі 2, 1.
S - электрондарының электрон бұлттары сфера (шар)
тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
сонда s электрондарының бұлттары өзара қабысып,
екі электрон екі ядроға да ортақ, олардан бірдей
қашықтықта орналасады.

Сутегі молекуласындағы атомдардың ұсталып тұрған күштерінің табиғатын алғаш 1927 жылы ағылшын ғалымдары Гейтлер мен Лондон кванттық механика тұрғысынан түсіндірді. Олар Шредингер теңдеуі бойынша
байланыстың екі сипатын - энергия мен ядро аралық ұзындықты есептеді. Сутегі молекуласы төрт микробөлшектен тұрады. Екі атом бір - біріне жақындаған кезде тартылыс күші, ал екі ядро мен екі электрон арасында тебілу күші пайда болады. Осы тартылыс және тебілу күші теңескен жағдайда молекула тұрақты күйге келеді.
H +1 )
1
Notes: При взаимодействии цинка с кислотой атомы цинка вытесняют атомы водорода из молекулы кислоты, а образующиеся атомы водорода соединяются в молекулу. Атом водорода представляет собой ядро, окружённое электронным облаком в форме шара, причём облако образовано одним электроном. Щ

H-
-H
H2
Сутек молекуласындағы байланыстың түзілуі:
Notes: Давайте попробуем разобраться как образуется связь в самой простой молекуле - молекуле водорода. Используем те знания, которые у нас есть.
Нарисуйте на доске строение атома водорода.
Проверяем. Щ


Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюсті молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
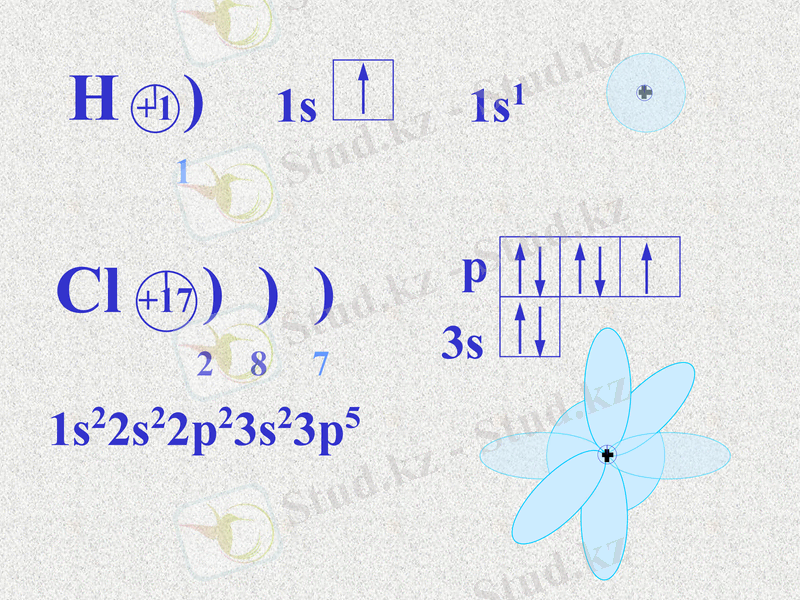
Cl +17 ) ) )
2 8 7
1s22s22p23s23p5
H +1 )
1

Металдық байланыстың түзілу схемасы (М - металл) : Me - ne- → Me+n
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр және жылу өткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т. б. бұлардың барлығы да металдық байланысқа тәуелді.
_
Металдық байланыс
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz