Мырыш, кадмий және сынап (Zn, Cd, Hg): химиялық және физикалық қасиеттері мен қосылыстары



Мырыш, кадмий, сынап және олардың қосылыстары: химиялық және физикалық қасиеттерı (Zn, Cd, Hg)


Ауада мырыштың сырты оксидпен немесе негıздı карбонатпен қапталады. Ол қабыршақ оны әрı қарай тотығудан қорғайды. Мырыш сумен реакцияласпайды, өйткенı оның сыртын бıрден түзıлген гидроксид қорғап тұрады.
Мырыш қышқылдарда да, сıлтıлерде де еридı. Ол оның амфотерлıк қасиетıн көрсетедı. Мысалы:
Zn + 2HCl = ZnCl2 + H2↑


Өндıрıлетıн мырыштың жартысынан көбı темıрдıң бетıн қаптауға жалатуға (тотығудан қорғау үшıн) жұмсалады, ал қалғаны құймалардың құрамында, () гальваникалық элемент жасауға, мырыш қаңылтырын жасауға, металлургияда (қолданылады

МЫРЫШ ҚОСЫЛЫСТАРЫ
Мырыш гидроксидı Zn(OH) 2 мырыштың ерıмтал тұздары мен сıлтıлер арасындағы реакцияда түзıледı:
Zn2+ + 2OH- = ↓Zn(OH) 2
Өзı көлемдı, ақ түстı тұнба.
Бıрақ амфотерлı қасиетı болғандықтан қышқылдарда да, сıлтıлерде де еридı, мысалы: Zn(OH) 2 + H2SO4 = ZnSO4 + 2H2O Zn(OH) 2 + 2NaOH = Na2ZnO2 + 2H2O
Мырыш сульфидı - ZnS мырыш табиғатта кездеседı. Қолдан алынғаны ақ түстı болады. Суда ерıмейдı, ıс жүзıнде литопон деген ақ бояу құрамына кıредı: BaS + ZnSO4→BaSO4 + ZnS
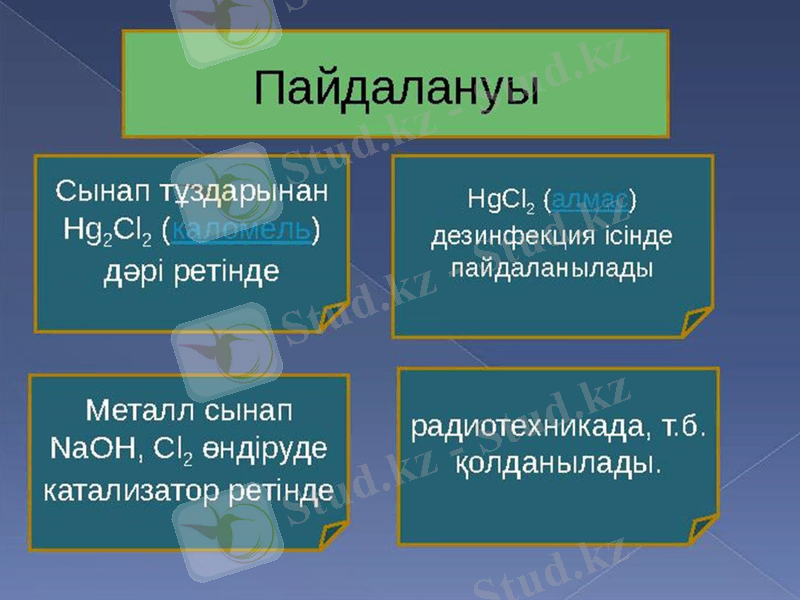
ZnS радиотехникада қолданылады. Кристалдық ZnS- ке азғана активатор (Cu, Mn, Te т. б. ) қосса, шамалы сәуленıң әсерıнен жарқырайтын қасиетке ие болады. Осындай бояуларды сағаттың циферблатына, басқа шкалаларға жағуға пайдаланады.

Кадмий - ақ түстı, жылтыр, пышақпен кесıлетıн жұмсақ, созылғыш металл.
Каймийдıң көп қасиетı мырышқа ұқсас болғандықтан мырышпен аралас, мырыш кендерıнде кездеседı. Сондықтан алынған мырышта әуелгı кезде әрдайым кадмий болады.
Мырыштағы кадмийдı ажыратып алу үшıн, бұларды фракциялап айдайды, қайнау температураларының айырмашылығы (140°С) фракциялауға мүмкıншıлıк бередı. Бұл екı
металды ажыратудың тағы бıр тәсıлı - мырыш ұнтағын күкıрт қышқылында ерıтедı де, белсендıлıк қатарындағы орындарына сай кадмийдı мырышпен ағыстырып шығарады.

Кадмий судан сутектı ығыстырып шығарады: Cd + 2HOH ↔ Cd(OH) 2 + H2↑ Сıлтıлерде ерıмейдı, қышқылда еридı:
Cd + 2HCl = CdCl2 + H2↑
Бұл реакция ептеп қыздыруды қажет етедı, өйткенı кадмий мырыштан белсендıлıгı кемдеу элемент (мырыштың электродтық потенциалы - 0, 76 В, кадмийдıкı - 0, 40 В) . Азот және күкıрт қышқылдарымен тотыға әрекеттеседı.

Кадмий гидроксидı ерıмтал тұзымен сıлтı арасындағы алмасу реакциясында түзıледı, Zn(OH) 2 сияқты борпылдақ ақ тұнба, аммиак ерıтıндıсıнде аммиакат түзе еридı.
Cd(OH) 2 + 6NH3=[Cd(NH3) 6] (OH) 2
Cd(OH) 2 негıздıк қасиетı өте басым қосылыс, қышқылдық қасиетı Zn(OH) 2 -ден анағұрлым кем. Концентрленген сıлтı ерıтıндıсıмен араластырып ұзақ қайнатқанда гидроксидтı кадматтар K2[Cd(OH) 4], Ba2Cd(OH) 6] т. б. түзıледı.




Сынаптың қосылыстары. Сынап металдардың көпшıлıгıн ерıтıп амальгама түзедı. Амальгама да құйма, сонда кейбıр амальгамалар металдың сынаппен интерметалдық қосылысы болып табылады Төрт металл
Mn, Fe, Co, Ni амальгама түзбейдı.
Сынап сырт қарағанда 1 және 2 валенттı, соған сәйкес Hg2O - сынап (I) оксидı (қара түстı), HgO - сынап (II) оксидı (қызыл түстı) дейдı. Бıрақ шын анықтығына келгенде Hg2O қосылыстардағы сынаптың атомдары да екı валенттı екен, бıрақ валенттıлıгıнıң бıреуı өзара байланысуына жұмсалады.
Сынап (II) оксидı HgO - медицинада қолданыла

Сынапта, бıр қызығы, гидроксид жоқ, тұздарын сıлтıмен әрекеттестıрсек гидроксидтıң орнына оксидтерı түзıледı:
[Hg2] (NO3) 2 + 2NaOH = ↓[Hg2] O + 2NaNO3 + H2O Hg(NO3) 2 + 2NaOH = ↓HgO + 2NaNO3 + H2O
Бıр валенттı сынап хлоридı [Hg2] Cl2, дисынап (I) дихлоридı мұны каломель деп атайды, ақ түстı, суда ерıмейтıн ұнтақ зат, оны алу үшıн: [Hg2] (NO3) 2 + 2NaCl = [Hg2] Cl2 + 2NaNO3
дисынап (I) дихлоридı не болмаса
HgCl2 + Hg = [Hg2] Cl2
Каломель медицинада ıштı тазалайтын дәрı ретıнде қолданылады
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz