Металдардың фазалық құрамы мен құрылымының қалыптасуы


Мазмұны
1. Кіріспе
- Металдардың фазалық құрамы мен құрылысының қалыптасуы3
2. Негізгі мазмұн
2. 1 Металдағы фазалық өзгерістер5
2. 2 Гиббс ережелері7
2. 3 Металдардың кристалдануы9
2. 3. 1 Кристалдану процесі10
3. Қорытынды12
4. Қосымшалар13
5. Глоссарий16
6. Әдебиеттер тізімі17
Кіріспе
Металдардың фазалық құрамы мен құрылысының қалыптасуы
Жалпы металдар мен қорытпалардың фазалық құрамы мен құрылысы- олардың температура мен қысымға байланысты жүретін түрлі фазалық өзгерістер нәтижесінде қалыптасады. Сонымен бірге, олардың фазалық құрамы мен құрылысы термиялық өңдеу үшін қыздырғанда, суық немесе ыстық күйде қысыммен өңдегенде және суық деформациядан кейін қайта қыздырганда өзгереді. Төменде металл құрылысының қалыптасуы- оларда жүретін өзгерістерге, температураға деформация дәрежесіне байланысты қарастырылады.
Физикалық химия мен термодинамикада таза металдар - бір комконентті, ал қорытпалар - екі, үш және көп компонентті системалар ретінде қарастырылады. Системаның химиялық және физикалық тұрғыдан біртекті, шекара бетімен шектелген бөлігін - фаза деп атайды. Кез келген термодинамикалық системаны толық білу үшін, оның фазалық күйін химиялық және физикалық тұрғыдан сипаттай білу керек.
Химия тұрғыдан системаның фазалық күйі оның құрамына кіретін фазалардың санымен, олардың химиялық құрамы және салыстырмалы шамалармен анықталады . Фазалардың химиялық құрамы оларға кіретін барлық қарапайым элменттердің (компонентердің) концентрацияларымен анықталады . Компоненттердің концентрациясына олардың атомдық үлестері немесе атомдық, салмақтық проценттері алынады. Ал фазалардың салыстырмалы шамалары деп - олардың микрокристалдардың металлографиялық үлгінің бет ауданының (көлемінің) бір бөлігіне келетін орташа өлшемін айтады. Кристалдардың орташа өлшемі ретінде олардың орташа диаметрін, көлденең қимасының ауданын немесе бет ауданының 1 см 2 келетін кристалдардың санын алады. Системаның фазалық күйін толық сипаттау үшін фазалық тепе- теңдік диаграмасын жақсы білу керек.
Термодинамикалық системаның фазалық күйін физикалық тұрғыдан толық сипаттау үшін оның құрамындағы барлық фазаның атомдық- кристалдық құрылысын білу керек . Фазалардың атомдық- кристалдық құрылысы дифракциялық (рентгенография, электронография, нейтронография) әдістердің көмегімен зерттеледі. Фазалық күй диаграммасын тұрғызғанда фазалардың құрылысын алдын ала білу міндетті емес .
Термодинамикалық системаның фазалық күйі температураға, қысымға және ішкі параметтрлерге (барлық фазалардағы компоненттер санына ) байланысты.
Физикалық химия курсынан белгілі Гиббстің фазалар ережесіне сәйкес системаға әсер ететін тәуелсіз айнымалы шамалар саны (С) фазалардың (Ф), компонеттердің (К) және сыртқы параметрлердің (П) санымен анықталады. Тәуелсіз айнымалы шамалардың саны (С) - системаның еркіндік дәрежесі деп аталады.
Көп жағдайда сыртқы тәуелсіз параметрлерге температура (Т) және қысым (Р) жатады. Мұндай системалар үшін П-2 . Егер системаға тағы да, мысалы сыртқы айнымалы өрістер (магнит, электр, гравитациялық, серпімділік өрістері) әсер етсе, онда П=3. 4 т. с. с. Системаның ішкі параметрлеріне барлық фазалардағы компоненттердің концентрациялары жатады . Әр фазадағы компоненттердің жалпы шамасын 100%-ке тең деп алатындықтан, кез келген фазадағы белгісіз канцентрациялар саны (К1), ал системаға кіретін барлық фазалардағы белгісіз, бір- бірінен тәуелсіз өзгере алатын концентрациялар саны Ф(К-1) . Сонымен жапы белгісіз параметрлер саны П=Ф(К-1) +2 системаның еркіндік дәрежесін (С) табу үшін, ондағы фалардың физика-химиялық байланыста болатынын ескеру керек. Ол үшін фазалар арасындағы тепе-теңдік шарттарын көрсететін математикалық теңдіктердің санын білу қажет . Екі фаза бір-бірімен тепе-теңдікте болуы үшін, олардың құрамындағы кез келген компоненттің сол фазалардағы химиялық потенциалдары тең болулары керек (М і 1= М і 2 ) . Мұндай тепе-теңдік шарттарының системадағы жалпы саны Т=К(Ф-1) . Сонымен, системаның еркіндік дәрежесі немесе тәуелсіз айнымалы шамаларының саны (тең болады) :
С=П-Т=Ф(К-1) +2-К(Ф-1) =К-Ф+2.
Металлургиялық процестер әдетте тұрақты атмосфералық қысымда жүреді. Сондықтан, сұйық және қатты металдар үшін фазалар ережесі жазылу түрі:
С=К-Ф+1.
Бүл- теңдік фазалар ережесі деп аталады.
Металдардың Фазалық өзгерістер
. Таза металдар басқа заттар сияқты температура мен қысымға байланысты өздерінің агрегаттық күйін өзгертіп, газ тәрізді, сұйық және қатты күйде бола алады. Сонымен бірге қатты металдарда аллотропиялық және магниттік өзгерістер жүруі мүмкін. Фазалық өзгерістер кезінде металдарда орын алатын фазалық тепе- теңдіктер: Пар»L сұйық ; L»S қатты ; а s »»b s ; парамагниттік металл» ферромагнитті металл (бір металдың магнитсіз және магнитті күйін екі фазалық күйі деп қарастырсақ) . Мұндай бір компонентті системалардағы екі фазалы тепе- теңдіктер үшін еркіндік дәрежесі
С=1 - 2 + 1 = 0. Сондықтан, жоғарыда көрсетілген фазалық өзгерістердің әрқайсысы өзіндік бір, тұрақты температурада жүреді . Фазалық өзгеріс аяқталмай, металдың температусын немесе басқа сыртқы параметрлерді өзгертсе, онда фазалық тепе-теңдік бұзылады да, системаның фазалық күйі өзгереді. Түсінікті болу үшін тағы бір мысал: екі компонентті қорытпалар кристалданғанда (L»»а) С= 2 - 2 + 1 = 1. Система бір вариантты, демек бір тәуелсіз парамерді (температураны және концентрациясы) белгілі бір аралықта өзгерткенде, системаның фазалық күйі (L»»а) өзгермейді. Егер екі компоненті системада фаза тепе- теңдікте болса, мысалы L»»(а+б), онда С= 2 - 3 + 1 = 0. Мұндай система вариантсыз деп есептеледі. Система вариантсыз. Басқа көп компонентті қорытпалар үшін фазалар ережесін қолдану кейінгі тарауларда қарастырылады.
Металдар мен қорытпалар фазалық күйінің температураға, қысымға және олардың химиялық құрамына байланыстылығы өте ыңғайлы, көрнекті график түріндегі ғылыми документ- фазалық күй диаграмаларының көмегімен көрсетіледі. Олар -
фазалық тепе- теңдік диаграммалары
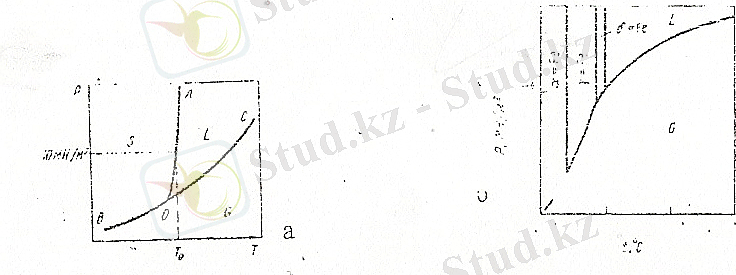
деп те аталады. Таза металдардың фазалық күй диаграммары « температура-қысым» координаттарында тұрғызылған жазық диаграммаларға жатады. (1а-суретте) бір компонентті системадағы фазалық тепе-теңдіктер диаграммасы көрсетілген. Диаграмманың ВОС сызығынан төменгі бөлігіне газ тәрізді металл (г), ал АОС бөлігінде- сұйық (L) және АОВ бөлігінде қатты (s) металл тұрақты болады. ОС, ОВ және ОА сызықтары екі фазалы L

 Г, S
Г, S

 Г және S
Г және S

 L тепе- теңдіктерді көрсетеді. Металды қыздырғанда (суытқанда) немесе күш еткенде осы сызықтарға сәйкес температуралар мен қысымдарда фазалық өзгерістер орын алады. О нүктесі- үштік нүкте деп аталады. Бұл нүктеге сәйкес келетін қысым (Р
0
) мен температурада (Т
0
) үш фаза бірдей тепе-теңдікте болады: L» S» Г.
L тепе- теңдіктерді көрсетеді. Металды қыздырғанда (суытқанда) немесе күш еткенде осы сызықтарға сәйкес температуралар мен қысымдарда фазалық өзгерістер орын алады. О нүктесі- үштік нүкте деп аталады. Бұл нүктеге сәйкес келетін қысым (Р
0
) мен температурада (Т
0
) үш фаза бірдей тепе-теңдікте болады: L» S» Г.
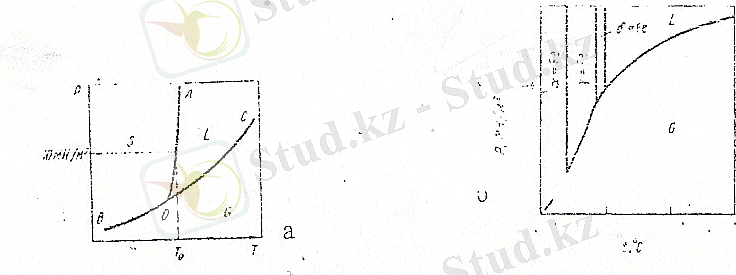
Қатты күйде аллотропиялық өзгерісі бар металдардың фазалық күй диаграммасында бірнеше үштік нүктелер болады. Өйткені, бір компонентті системада тепе-теңдікте болатын фазалардың саны үштен артық бола алмайды. Тек бір үштік нүкте сұйық, қатты және газ тәрізді фазалардың тепе-теңдігіне сәйкес келеді. Қалған үштік нүктелер газбен металдың басқа екі аллотропиялық түрлерінің арасындағы тепе -теңдіктерді көрсетеді. Мысал ретінде 1б- суретте таза темірдің тәжірибе
 жүзінде тұрғызылған фазалық күй диаграммасы көрсетілген.
жүзінде тұрғызылған фазалық күй диаграммасы көрсетілген.
1-Сурет
а)
б)
а-таза металдың фазалық күй диаграммасы
б-таза темірдің фазалық күй диаграммасы
Фазалар ережесі
Гиббстың фазалар ережесі күй диаграммасының дұрыстығы мен заттардың кристалдану процесін түсіндіреді.
Фазалар ережесін бастаудан бұрын металл тану ғылымында қолданатын бірнеше терминге анықтама берейік . Белгілі бір температура, қысым жағдайында белгілі бір көлемге ие болатын қатты, сұйық, газ күйіндегі заттар (фазалар) жиынтығын система деп атайды. Ал система қарапайым және күрделі, біртекті (гомогенді) және әр текті (гетерогенді) болып екіге бөлінеді. Системаны құрайтын элементтер немесе тәуелсіз химиялық қосылыстар құраушылар деп аталады. Әр текті системаның белгілі бір шекарамен шектелген біртекті бөлігін фаза деп атайды. Мәселен, 273 0 К (0 0 ) температура кезінде, белгілі бір атмосфералық қысымда беті жабық ыдыстың ішінде мұз кесектері мен су бар делік. Ыдыстың беті жабық болғандықтан су деңгейінің жоғары жағында су буы болады. Система- әр текті (гетерогенді ) үш фазалы, күрделі система болсын. Система фазалары : су- сұйық фаза, мұз - қатты фаза және су буы -газ тәрізді фаза. Фазалар ережесі тепе -теңдік күйіндегі системаның құраушылары мен фазаларының арасындағы заңдылықтарды анықтайды. Системаның тепе-теңдік шарттары температура, қысым, көлем параметрлерімен анықталады. Әдетте қорытпа қалыпты жағдайда зерттелетіндіктен, қысым атмосфералық қысымға тең болады.
Системаның фаза санын өзгертпей, күйін өзгерте алатын ішкі және сыртқы себептер ( температура, концентрация, қысым) санын системаның варианттылығы немесе еркіндік дәрежесінің саны деп атайды.
Фазалар ережесі системаның тепе-теңдік күйінің математикалық өрнегін береді. Ол мынау:
C= К - Ф + 1,
Мұндағы С - еркіндік дәрежесінің саны,
К - құраушылар саны,
Ф- фаза саны.
Металдардың кристалдануы
Сұйық металдарда атомдар ( иондар) газдардағы сияқты кездейсоқ орналасып, еркін қозғала алады . Атомдар реттеліп орналасуға бейім . Кез келген отомның жақын төңірегінде, белгілі бір қашықтықта орналасқан, әр температураға сәйкес көрші атомдар топтары болады. Бірақ күшті жылулық қозғалыстың әсерінен мұндай атомдардың топтары үнемі бұзылып, тарап және қайта пайда болып отырады. Тіпті изотермиялық жағдайда да, әрбір атом тобының кеңістікте бағытталуы және оған кіретін атомдардың саны мен құрамы уақытқа байланысты өзгеріп отырады. Металдың кристалдану температурасына жақын температуралардағы мұндай таптардағы (координациялық сфераның ішіндегі ) атомдардың орналасуы, олардың қатты металдағы ретті орналасуына ұқсас болады. Температура жоғарлағанда атомдардың реттелу дәрежесі төмендеп, әр атомның координациялық саны азаяды. Жалпы сұйық күйде нағыз метал атомдарының координайциялық саны қатты күйдегіден әрқашанда аз болады. Ал, ковалентті байланысы бар металлоидтардың, жартылай өткізгіштердің атомының сұйық күйде координацилық сандары қатты күйдегісінен жоғары болады.
Барлық сұйық металдарда орташа атомаралық қашықтық қатты күйдегіден үлкен. Қатты метал балқыған кезде оның көлемі 2 - 6 %- ке дейін үлкейеді. Атомдардың орналасу тығыздығы азаяды. Ал ковалентті байланысы бар, қатты күйде тығыздығы аз металлоидтар (Si, Ge, Bi, Ce, т. б. ) бақығанда олардың көлемдері азайып, тығыздықтары артады.
Сұйық металдың еркін энергиясы қатты күйдегіден әрқашан үлкен. Сонымен бірге, сұйық металдың көлемінде оның химиялық құрамы, атомаралық байланыс энергиясы әр жерде әртүрлі, өзгермелі болып келеді (флуктуациясы) . Сұйық металдың тығыздығы да әр жерде әртүрлі. Сұйық металдың қасиеттері изотропты, демек олардың мәндері барлық бағытта бірдей болып келеді.
Сұйық металдағы атомдардың координациялық сфераның ішіндегі орналасуын жақындағы реттелу , ал атомдардың қатты металдың кристалдық торының орналасуын - алыстағы реттелу деп атайды. Алыстағы реттелу кезінде атомдардың орташа арақашықтары, координациялық сандары мен ондағы кристаллографиялық бағыттар арасындағы бұрыштар қатынастары жеке элементар ұяда ғана емес, тұтас микрокристалдың ішінде тұрақты болады.
Кристалдану процесі
Жоғарыда көрсетілгендей, металдармен мен қорытпалар қатты күйінде поли кристалдық заттарға жатады. Әрбір жеке микрокристалдың ішінде атомдар (иондар) белгілі ретпен орналасып, кристалдық тор құрады. Металдың кристалдық құрылысының ерекшеліктері оның кристалдану процесіне үлкен әсерін тигізеді.
Егер сұйық металды немесе қорытпаны суытқанда фазалық өзгерістер жүрмесе, онда оның агрегаттық күйі өзгермей, бөлме температурасында аморфты материал пайда болады. Аморфты металдар мен қорытпалардың кристалдық торы болмайды. Атомдар ретсіз орналасқандықтан, суытқанда сұйық фазадағы орташа атомаралық қашықтық біртеө бірте азаяды.
Аморфты металдар мен қорытпаларды алу мен қолданудың ғылым мен техникада үлкен маңызы бар. Өйткені көп жағдайда олардың беріктік шегі мен коррозияға шыдамдығы өте жоғары. Аморфты заттардың анизотропиясы жоқ болғандықтан, магниттелу қабілеті де жоғары болады. Басқа да айрықша физики- химиялық, механикалық қасиеттері бар көптеген аморфты заттар техникада кең қолданылады.
Қазіргі кезде аморфты металдар мен қорытпаларды алу әдістері оларды сұйық күйден өте тез суытуға ( суыту жылдамдығы 10 8 - 10 9 град/сек) және арнаулы аморфтандырушы металлоидтармен (С, B, Si) легірлеуге негізделген.
Физикалық зерттеуге сүйене отырып, аморфты металдар мен қорытпалар-олардың асыра суытылған сұйық күйі деп есептеуге болады. 2-суретте агрегаттық күйін өзгертпейтін аморфты зат (а) пен металдың (ә, б) суыну сызықтары көрсетілген.
Таза сұйық металды суытқанда ол кристалдану температурасында (Т s ) қатты кристалдық күйге өтуі -кристалдану деп аталады. Кристалдану кезінде әр металдың өзіне тән ішкі фазалық өзгеріс энергиясы -кристалдану жылулығы бөлініп шығады. Фазалық өзгеріс кезінде іштей бөлінген жылу мөлшері қоршаған ортаға тарайтын жылу энергиясына тең болса, кристалдану белгілі уақыт ішінде тұрақты температурада жүреді.
Кристалдану процесінің механизмдері
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz