Орта мектепте химиялық байланыс және зат құрылысы тақырыбын оқыту әдістемесі


МАЗМҰНЫ
КІРІСПЕ. . . . 3
1 ХИМИЯЛЫҚ БАЙЛАНЫС ЖӘНЕ ЗАТ ҚҰРЫЛЫСЫ ТАҚЫРЫБЫНА ӘДЕБИ ШОЛУ . . . 5
1. 1 Химиялық байланыс және зат құрылысы ұғымының дамуы . . . 5
1. 2 Химияны оқытудың қазіргі заманғы технологиялары . . . 33
1. 3і«Химиялық байланыстар және зат құрылысы» тақырыбын оқыту әдістемесінің ерекшеліктері . . . 44
2 ХИМИЯЛЫҚ БАЙЛАНЫС ТАҚЫРЫБЫН ОҚЫТУ ӘДІСТЕМЕСІ . . . 54
2. 1і«Атом құрылысы. Химиялық байланыс» тақырыбындағы сабақты ойын әдісімен оқыту әдістемесі . . . 54
2. 2і«Химиялық байланыс. Зат құрылысы» тақырыбын қайталау және қорытындылау сабағының әдістемесі . . . 60
2. 3і11 сыныпқа арналған «Химиялық байланыс» тақырыбын сыни тұрғыда ойлау технологиясымен оқыту . . . 63
2. 4 Алынған нәтижелерді сараптау . . . 67
ҚОРЫТЫНДЫ . . . 71
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ . . . 73
КІРІСПЕ
Тақырыптың өзектілігі . Ұлттық білім үлгісінің негізгі бағыты - адамды қоғамның ең негізгі құндылығы ретінде тану, оның қоғамдағы орны мен рөліне, әлеуметтік жағдайына, психикалық даму ерекшелігіне мән беру, сол арқылы оның рухани жан-дүниесінің баюына, саяси көзқарасының, творчестволық еркіңдігі мен белсенділігінің, кәсіби іскерлігінің қалыптасуына жағдай жасау, мүмкіндік беру. Яғни, XXI ғасырдық маманы - жаратылыстану мен гумани-тарлық ғылымдар бойынша ой-өрісі кең, жан-дүниесі бай, ұлттық менталитеті жоғары, кәсіби білікті маман, адамдармен дұрыс қарым-қатынас жасай алатын, басқаның пікірімен санасатын, кез-келген ситуациядан шығудың жолын таба алатын, жауапкершілік сезімі жоғары, қоғамда белгілі бір рөл атқаратын, қайталанбайтын дара тұлға болуы тиіс. Ал мұндай мүмкіндіктің негізі - жоғары білімде. Өйткені жоғары білім - үздіксіз білім беру жүйесінің шешуші тетігі.
Мемлекеттік білім стандарт деңгейінде оқыту үрдісін ұйымдастыру жаңа педагогикалық технологияларды ендіруді міндеттейді.
Білім беру саласы қызметкерлерінің алдында қойылып отырған басты мін-деттерінің бірі-оқытудың әдіс-тәсілдерін үнемі жетілдіріп отыру және қазіргі заманғы педагогикалық технологияларды меңгеру.
Еліміздің егемендік алып, қоғамдық өмірдің барлық, соның ішінде білім беру саласында жүріп жатқан демократияландыру мен ізгілендіру мектепті осы кезге дейінгі дағдарыстан шығаратын қуатты талпыныстарға жол ашты.
Білім мазмұны жаңа үрдістік біліктермен, ақпаратты қабылдау қабілеттері-нің дамуымен, ғылымдағы шығармашылық және нарық жағдай-ындағы білім беру бағдарламаларының нақтылануымен байи түсуде. Атап айтқанда:
• Есте сақтауға негізделген оқып білім алудан, бұрынғы меңгергендерді пайдалана отырып, ақыл-ойды дамытатын оқуға көшу;
• Білімнің статистикалық үлгісінен ақыл-ой әрекетінің динамикалық құрылым жүйесіне көшу;
Тақырыптың зерттеліну деңгейі . Оқытудың технологиясы білім берудің теориялық және қызметтік негізін қалыптастыруда, білімді еңбекпен ұштас-тырып, іс-әрекеттің сапалығын дамытады, мақсатты өмір сүруге ұмтылуға әсер етеді. Оқыту технологиясы оқу бағдарламаларында қарастырылған алға қойған мақсатқа жетудің тиімділігін қамтамасыз ететін оқытудың әдіс-құрал түрлері-нің жүйесі арқылы оқыту мазмұнын жүзеге асыру жолы. Оқыту технология-сында мазмұн, әдіс және құралдардың өзара байланысы мен себептілігі жатыр, ал қажетті мазмұнда, тиімді әдістер мен құралдарды, бағдарлама мен алға қойылған педагогикалық міндетке сәйкес іріктей білу.
Оқытудың қазіргі заманғы тенденциялары жоғары білікті маман даярлаудың жаңартылған сапалы өзгерістерін талап етіп отыр. Осы орайда студенттерге жоғары білімнің сапасын арттыру мақсатында әр түрлі бағытта және жаңа әдістерді пайдалана отырып білім беру үлкен маңызға ие. Оқу процесінің сапасын қамтамасыз етуде оқыту әдістерінің атқарар қызметі зор, себебі ол оқу процесін ұйымдастырудың тиімділігін көрсететін фактор болып табылады. Химияны оқыту әдістемесінде ( С. Г. Шаповаленко, Ю. В. Ходаков, М. Я. Голобродько, В. Н. Давыдов, Н. А. Титов, П. А. Оржековский) оқушылардың шығармашылық қызмет тәжірибесін қалыптастыруға арналған бірқатар зерт-теулер бар.
Химиялық байланыс туралы ілім - химияның өзекті де өткір, әрі орталық мәселесі. Заттағы атомдардың әрекеттесу табиғатын түсінбей тұрып, химиялық қосылыстардың көп қырлы да жан-жақты болу себебін түсінуге, олардың түзілу механизмін, құрамын, құрылымы мен құрылымын және реакцияласу қабілет-тілігін елестету, түсіну және нанымды мазмұндау мүмкін емес.
Диплом жұмысының мақсаты . Орта мектептің химия курсын оқыту барысында химиялық байланыстар және зат құрылысы тарауын оқытудың әдіс-темесін жасау.
Диплом жұмысының міндеттері :
-химиялық байланыстар, олардың типтері мен заттар құрылысына теориялық әдістемелік шолу;
-орта мектепте химия курсында «Химиялық байланыстар және зат құрылысы» тарауының орны мен мазмұнын анықтау;
- «Атом құрылысы. Химиялық байланыс» тақырыбындағы сабақты ойын әдісімен оқыту әдістемесі
-«Химиялық байланыс. Зат құрылысы» тақырыбын қайталау және қорытындылау сабағының әдістемесі
- 11 сыныпқа арналған «Химиялық байланыс» тақырыбын сыни тұрғыда ойлау технологиясымен оқыту әдістемесін жасау;
- орта мектепте өткізілген сабақтардың нәтижелерін талдау;
- зерттеу бойынша берілген негізгі ұсыныстар мен әдістерді педагогикалық экспериментке қою және оның оң нәтижелерін анықтау.
Зерттеу обьектісі. Негізгі мектепте химияны оқыту үрдісі.
Зерттеу пәні.
Орта мектеп химия курсында оқушыларға химиялық бай-ланыстар және зат құрылысын оқыту.
Жұмыстың ғылыми жаңалығы.
1. Негізі мектеп химиясы бойынша химиялық байланыс және зат құрылы-сы тақырыбын оқуға негізделді.
2. Химия пәні бойынша оқушылардың білімін тереңдетіп, қызығушылы-ғын арттыра отырып, мектептің жоғары сатысында дұрыс бағдар таңдауға негіз болатындығы сараланды.
Зерттеудiң ғылыми әдiстерi .
Педагогикалық эксперимент жүргізу, арнайы бақылау, мұғалімдермен, оқушылармен сұхбаттасу, сауалнама, педагогикалық эксперимент нәтижелерін сұрыптау.
Диплом жұмысының құрылымы кіріспеден, екі бөлімнен, қорытынды мен пайдаланылған әдебиеттер тізімінен тұрады.
ХИМИЯЛЫҚ БАЙЛАНЫС ЖӘНЕ ЗАТ ҚҰРЫЛЫСЫ ТАҚЫРЫБЫНА ӘДЕБИ ШОЛУ
1. 1 Химиялық байланыс және зат құрылысы ұғымының дамуы
Химиялық байланыстың табиғаты - химияның ең негізгі мәселелерінің бірі. Мұндағы негізгі сұрақ не себептен атомдар бірігіп молекула түзеді? Атом-дарды байланыстыратын күштің табиғаты қандай?
Заттың құрылысы туралы алғашқы атомистикалық ілім пайда болғалы аса жақсы ғылыми тірек бермесе де ойлау, ойлану, тәжірибе арқылы зерделеу ісін біртіндеп дұрыс жолға қоя бастады. Нәтижеде заттың ең кіші бөлшектерінен корпускула (молекула) арқылы атомға қарай жеткізіп, химиялық байланысты жай механикалық байланыстан бастап түрлі ілгек, тұзақ, жай байланыс арқылы электрге әкелді.
XIX ғасырдың басында Г. Деви және И. Берцелиус жаңа теория жасап ұсынды, оған сәйкес бөлшектердің химиялық әрекеттесуі тұсында, бұған қатыс-қан әрбір бөлшек біріне-бірі қарсы зарядталады да бұл байланысты тудырады. Бұл электрохимиялық теория бірдей атомдардан түзілген малекуланың (мысалы: Н 2 ; СІ 2 ; О 2 және т. б. ) табиғатын түсіндіре алмайды [1] .
1852жылы ағылшын ғалымы Франклид химияға атомдылық деген түсінік ензгізді. Көп кешікпей бұл түсінік валенттілік деп аталады. Химияға валент-тілік туралы ұғымның енуі химияның ары қарай дамуына үлкен әсерін тигізді.
1861жылы орыстың ұлы ғалымы А. Н. Бутлеров заттардың химиялық құр-ылыс теориясын ұсынды. Химиялық құрылыс теориясы органикалық химия курсында қарастырылады. Біз бұл теорияның негізгі қағидаларына ғана тоқ-талып өтеміз.
- Қай заттың болсын молекуласындағы атомдар бірімен - бірі белгілі ретпен қосылысқан.
- Молекуланың құрамындағы атомдар өзді-өзі тікелей не болмасабасқа атом арқылы қосылысса да біріне -бірі әсер етеді.
- Заттың қасиеті молекуладағы атомдардың қосылу ретіне және олардың біріне -бірінің әсеріне, яғни «химиялық құрылысына» тәуелді.
- Заттың химиялық қасиеттеріне сүйнен отырып, оның молекуласының құрылысын анықтауға болады, керісінше, формуласы бойынша оның қасиеттерін болжауға болады.
Бутлеровтың құрылыс теориясы химиялық қосылыстардың сан түрлілігін және изомерия құбылыстарын түсіндіріп, молеуланың құрылысын анықтаудың нақты жолдарын көрсетті. Бұл теория молекуланың құрылысы туралы ілімнің негізі болып табылады.
Бутлеровтың құрылыс теориясы әрмен қарай Голландия ғалымы Вант -Гофф пен Франция ғалымы Ле Бель дамытты. Олар 1874жылы көміртек атомының валенттіліктері тетраэдердің төбелеріне бағытталған деген болжам айтты. Вант -Гофф пен Ле Бел пікірі бойынша, егер көміртек атомын тетра-эдрдың центрінде орналасқан деп есептесе, оның валенттіліктері тетраэдрдың төбелеріне қарай бағытталып, бірімен -бірі 109, 5° бұрыш жасап тұрады. Кейінірек органикалық молекулалардың құрылысы физикалық әдістермен зерттеліп, Вант -Гофф пен Ле Бель постулатының дұрыстығын айқындалды. Сонымен қатар, XIX ғасырдың аяғында валенттілік күштерінің белгілі бір бағыты болатыны ашылды. Бутлеров пен Вант-Гофф, Ле Бель еңбектері заттар молекуласының құрылысын танып білуге көмегін тигізді. Бірақ осыған қарамастан XIX ғасырда атомдардың молекулаға бірігу себебі және валент-тіліктің мазмұны әлі де белгісіз болып қала береді. Бұл сұрақтарға жауап тек біздің ғасырымызда атом құрылысы анықталғаннан кейін барып табылды. Қазіргі кездегі электронддық қабаттарының әсерлесуі нәтижесінде пайда болады. Демек, атомдарды байлыныстыратын күштердің электрлік табиғаты бар деп есептіледі [2] .
1907жылы Дж. Томсон бірінші болып электрондық тұжырымдамасын ұсынды. Мұнда атомдар белгілі бір электрондық құрылымда болады. электронды беру не қосып алу кезінде химиялық байланыс туындайды екен.
1916жылы неміс ғалымы В. Коссель атомдар мен молекулалардың электро-статикалық теориясын тұжырымдады, оның негізгі ережелері келесідей:
1) инертті газдардың атомдарында екі немесе сегіз электронды тұрақты сыртқы қабаты болады;
2) басқа элементтердің атомдарында екіден немесе сегізден аз электронды қабаты болады. олардың электрондық қабаттары (қауыздары) тұрақсыздау;
3) молекулалардың түзілуі бір элеметтің (металдың) атомынан белгілі бір сандағы электрондарды басқа элементтің (бейметалдың) атомына беруі салдарынан іске асады.
Мұндай қайта бөлісу нәтижесінде металл атомы оң зарядты қабылдайды, ал бейметалл -теріс зарядты. Олардың арасындағы қосылыс электростатикалық тартылу күштерімен байланысты. В. Корсель идеясы байланыстың иондық теориясын жасауға негізгі тірек болды. Бірақ та бұл теория да бірдей атомдардың арасындағы байланыстың табиғатын түсіндіре алмады.
Сол 1916жылы американдық ғалым Г. Льюис, молекулалардағы тұрақты сыртқы электрондық конфигурациялардың пайда болуы, екі атом арасында ортақ, екеуіне де бірдей жалпыланған электрондардың түзілуінен шығар дегендей болжамды ұсынды. Мұндай жағдайдағы химиялық байланыс жалпы электрондық жұптың түзілуі арқылы жүреді, оған, яғни элекрондық жұпқа, әрбір атом өзінің сыртқы электрондық қабатынан бір электроннан береді. Бұл байланысты ковалентті, яғни бірге әрекет етуші деп атайды.
Бұл теориялардың барлығы химиялық байланыс жайлы электрондық түсініктің дамуына қосылған аса маңызды үлес еді. Бірақ олар да сапалық сипатта болып, химиялық байланыстардың түзілу механизмін айқындаған жоқ және де оның сандық сипаттамасын есептеуге мүмкіндік бермеді [3] .
Химиялық байланыстың үш түрі бар: коваленттік, иондық, және металдық байланыс.
Өзімізді қоршаған дүниеліктердің құрамына қарай жай жэне күрделі заттар болып екі түрге бөлінетіні белгілі. Жай зат болсын, күрделі зат болсын өте ұсақ атом-молекулалардан тұратыны аян. Енді, осы бөлшектерді өзара байланыс-тырып түратын күш табиғатына тоқталалық.
XIX - ғасыр басында фращуз химигі Бертолле Клод Луй (1748-1822) зат құрамындағы химиялық элементтердің өзара байланыс жасауын бүкіл элемдік тартылыс заңымен түсіндірді. Аталған көзқарас бойынша массасы жеңіл элементтерге қарағанда, ауыр элементтер берік қосылыс түзуі тиіс. Ал енді, қосылыс табиғаты мен беріктігіне назар аударсақ, бұған керісінше, жеңіл элементтерден құралған зат молекулаларының байланысы өте берік болатындығын аңғару қиын емес [4] .
Швед ғалымы Берцеллиус Иенс Якоб (1779-1848) болса, химиялық элементгер арасындағы байланысты олардың электрлік қасиеті тұрғысынан қарастырды. Бұл түсінік бойынша химиялық элементтердің бір түрінде оң, ал екіншілерінде теріс заряд басым болады. Оң заряды басым элементтерге металдарды, ал теріс заряды басым элементтерге металл еместерді жатқыза отырып, химиялық қосылыстар осылардың арасындағы тартылыстан туын-дайды ден есептелінді. Аталған ілім біртүрлі атомдардан тұратын оттегі, сутегі, азот сияқты жай заттар арасындағы байланысты түсіндіре алмады [5] .
Химиялық элементтердің өзара байланысқа түсуін атомдардың элек-трон қосып алу иемесе беріп жіберу нэтижесінде зарядты бөлшекке айналып электрлік тартылыс әсерінен жүзеге асады деген көзқарасты В. Нернст, Р. Абегг және Бодлендерлер болды.
1904ж. Р. Абегг электрлік валенттілік үғымын кіргізіп, әрбір элемент оң да теріс те валенттілік көрсете алатындығын және осы шамалардың абсолюттік қосындысы сегізден артпайтындығын ұсынды. Р. Абептің ұсынысының период-тық кестемен өте тьғыз байланыста болатындығын төмендегі жүйелеуден аңғаруға болады [6] .
Р. Абеггтің молекуланы құрайтын кейбір атомдардың байланысы арасындағы «полюстік сипат», яғни полярлылық жорамалы химиялық байланысты дамытуда үлкен маңызға ие болды (Кесте 1) .
Кесте 1
Абегтің кестесі
0
-8
+1
-7
+2
-6
+3
-5
-3
+5
-2
+6
-1
+7
*Контрваленттілік деп металдардың теріс, ал металл еместердің валенттілігін Абегг осылай атаған.
Электртерістілік ұғымын ендіру керек. Химиялық байланыстың түзілуі электртерістілікке байланысты. Электртерістілік бұл - химиялық элемент атом-дарының химиялық байланыс түзуге қатысатын электрон жұбын тарту қабілеті. Полинг бойынша элементтердің салыстырмалы электртерістілік мәндері төмен-дегі кестеде келтірілген (Кесте 2) .
Кесте 2
Элементтердің салыстырмалы электртерістілігі
2, 1
-
0, 97
1, 47
2, 01
2, 50
3, 07
3, 5
4, 10
-
1, 01
1, 23
1, 47
1, 74
2, 1
2, 6
2, 83
-
0, 91
1, 04
1, 20
1, 32
1, 45
1, 56
1, 60
1, 64
1, 70
1, 75
1, 75
1, 66
1, 82
2, 02
2, 20
2, 48
2, 74
-
0, 89
0, 99
1, 11
1, 22
1, 23
1, 30
1, 36
1, 42
1, 45
1, 35
1, 42
1, 46
1, 49
1, 72
1, 82
2, 01
2, 21
-
0, 86
0, 97
1, 08
1, 23
1, 33
1, 40
1, 46
1, 52
1, 55
1, 44
1, 42
1, 44
1, 44
1, 55
1, 67
1, 76
1, 90
-
0, 86
0, 97
1, 00
**Актиноидтар - 1, 11 - 1, 20
Химиялық элементтерді байланыстырушы күш атомдардың сыртқы электрон қабатындағы электрондардың жұпталуы деген көзқараста Н. А. Морозов, И. Штарктар болды. Ал В. Коссель болса Э. Резерфорд, Н. Бор пікірлерін ескере отырып 1916ж. өз еңбегінде атомдардың инертті газ электрондық құрылымына ие болуға ұмтылатындығын негізге алды. Химиялық элементтердің теріс не оң электрлік қасиетке ие болып байланыс түзуі, олардың сыртқы қабатында екі немесе сегіз электрондық құрылымға ұмтылуынан деп түсіндіріледі. Электрон беру не қосып алу нәтижесінде түзілген иондар - иоидық байланыстың негізін құрайды деген тұжырым жасалынады [7] .
Бүгінгі таңдағы көзқарас бойынща қосылыстардағы элемент-тердің өзара байланысы - электрондармен ядро арасындағы электростати-калық тартылыс күштері негізінде жүзеге асатындығы дәлелденді және оларды ковалентті, ионды және металдық байланыстар деп үшке бөледі. Енді осы байланыстарды жеке-жеке қарастыралық.
Химиялық байланыстың түрлері. Коваленттік байланыс
Коваленттік байланыс. 1916жылы американ ғалымы Льюис химиялық байланыстың электрондық теориясын ұсынды. Бұл теория бойынша екі атом бір-бірімен екеуіне ортақ электрон жұбы (қосағы) арқылы байланысады. Химиялық байланыстың түлері төмендегі кестеде көрсетілген (Кесте 3) .
Кесте 3
Химиялық байланыстың түрлері және олардың негізі қасиеттері
Элемент
тердің сипаттамасы
Түзілетін бөлшек
тер
Крис
талл торлары
Валентті электрондар
дың ауысуы
Бейметал
дар атомдары (металл атомдары сирек)
Ортақ электрон жұбының түзілуі және молекулалық орбитальдар
дың толуы
Молекулалар
Моле
кулалық
Br 2
CO 2 C 6 H 6
Атом
дық
Оң зарядтал
ған иондар
Металдаржәне құйма
лар
1. Cыртқы қабатында 2 немесе 8 электроны бар инертті газдар химиялық жағынан өте инертті демек, мұндай газдардың электрондық қабаты өте тұрақты. Атомдар молекула құып біріккенде ортақ электрон қосағын түзу арқылы өздерінің сыртқы қабаттарын инертті газдардікіндей етуге тырысады.
2. Химиялық байланыс әсерлесуші атомдардың екеіне де ортақ электрон жұбы арқылы жасалады. Бір электрон жұбын түзу үшін әр атом бір - бір электроннан жұмсайды.
Бір болмаса бірнеше электрон жұптары арқылы түзілетін химиялық байланыс коваленттік байланыс деп аталады. Хлор және азот молекуласының түзілуін қарастырайық. Атомның сыртқы қабатынадғы әр электронды бір нүктемен белгілеп, хлор және азот молекулаларының түзілін мынадай схема түрінде көрсетуге болады.
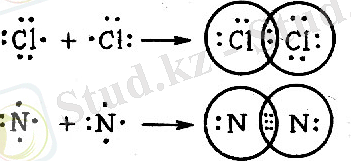
Хлор атомының сыртқы қабатында жеті электрон бар. Хлор молекуласы түзілгенде әр атом бір электроннан беріп, ортақ бір электрон жұбы түзіледі. Сөйтіп, молекуладағы әр атомның сыртқы қабаты инертті газдардікіндей оттекке (сегіз электрондық қабатқа) айналады. Азот молекуласы түзілгенде үш ортақ электрон қосағы пайда болып, молекула құрамындағы әрбір азот атомының сыртқы қабаты сегіз электрондық қабатқа айналады.
Төменгі схемада Льюис теориясы бойынша су, аммиак және метан молеку-лаларының құрылыстары келтірілген.
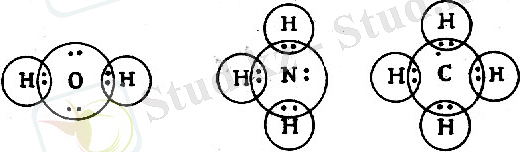
Молекула озара бір-бірімен байланысқан атомдардан тұрады. Атом-дардағы электрондарды өзара қарама-қарсы бағытқа бағытталған түрде көрсетеміз:
↑ және↓
Және бұл екі жұп екі атомның ядроларының ортасында орналасады. Екеуі де оң зарядталған атомдар ядролары теріс электрон жұбына, яғни бір-біріне тартылады:

Міне, осылайша екі жеке атомдардан, қарапайым екі атомды молекула түзіледі. Мысалы, сутектің Н екі атомынан Н 2 молекуласы түзіледі.
H + H = H 2
Не себептен екі электон бір-бірімен бірігіп электрондық жұп түзіледі? Бұл Сұраққа жауап беру үшін келесі мәселелерді ескеру қажет:
Әрбір электрон, электрлік заряд секілді, магнитті моментке ие, сондықтан олар микроскопиялық магнит секілді әсер етеді. Қарама-қарсы бағытқа бағытталған екі электрон - қарама-қарсы бағытқа бағытталған полюсі бар екі микромагнит секілді. Сондықтан да, олар бір-біріне тартылады Оны келесі түрде бейнелеуге болады.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz