Орта мектепте периодтық заң мен Д.И. Менделеевтің периодтық жүйесін оқытудың әдістемесі мен маңызы


КІРІСПЕ
Тақырыптың өзектілігі : Елбасы Н. Ә. Назарбаев мемлекетіміздің бола-шақ дамуына арналған «Қазақстан-2030» бағдарламасында жоғары білімнің сапалылығына жеке адамның тәрбие сапасы мен мәдениетінің жоғары болуына ықпал ететін интеграциялық рольге ерекше мән берген болатын.
Республиканың әлеуметтік экономикалық дамуын жеделдетуге қоғам-ның саяси және рухани өмірі саласындағы міндеттерді қайта жаңартуға бағытталған идеялық тәрбие жұмыстары мемлекеттің стратегиялық бағ-дарымен анықталады. Сонымен «Бүгінгі таңда қоғамның ұлттық мәдени тұрғыдан кемелденуі жас ұрпақты өз халқының рухани қазынасымен, ұлттық тәрбиенің озық, өнегелі дәстүрлерімен тереңірек таныстыру, соның негізінде жеке тұлғаны қалыптастырып, оның шығармашылық мүмкіндіктерін дамыту көзделеді» деген яғни еліміздің болашағы жас ұрпақтың білімі мен тәрбиесінің деңгейіне байланысты.
Қазіргі мектеп алдындағы негізгі міндеттің бірі әр жасөспірімнің қалыптасып дамуында өзі күнделікті өмірден көретін, сезінетін, еститін заттары мен құбылыстары, оқиғалары үлкен орын алады. Ертеңгі келер күннің бүгінгіден де нұрлы болуына ықпал етіп адамзат қоғамын алға апаратын құдыретті күш тек білімге ғана тән. Қай елдің болсын, өсіп өркендеуі өркениетті дүниеде өзіндік орын алуы, оның ұлттық білім жүйесінің деңгейіне, даму бағытына тікелей байланысты. Білім берудің негізгі мақсаты - оның жан-жақты әрі тұтас тұлғаны тәрбиелеудің құралы ретінде оқушылардың шығармашылық пен ойлау қабілетін дамыту, сөйтіп, өмірдің қай саласында болмасын, еркін және дәлме-дәл жауаптылық пен ойлау қабілетін сіңіру, әртүрлі жағдайларда жинақы болуға баулу.
Тақырыптың зерттеліну деңгейі . Педагогикада оқу - тәрбие процесінде оқушылардың белсенділігін жоғарылатудың жолдары үздіксіз түрде жүргізілетіндігі көрсетіледі. Оқу үдерісінде оқушылардың өз бетінше және белсенділік принципі атақты дидакт М. Н. Скаткиннің жұмыстарында ұсыныл-ды. Кейін ол М. И. Махмутова, Т. И. Шамова, Н. А. Половникова, Д. В. Вилькеева, И. Я. Лернер зерттеулерінде дамыды. Бірақтан да алдыңғы ғасырдың 80-жылдарына дейін бұл бағытты зерттеу оқытуды ұйымдас-тырудың бір түрі-тек сабақта ғана жүргізілді. Сабақтың әр кезеңдерінде оқушыларды белсенділігін арттырудың тәсілдері қарастырылды. Зерттеушілер оқу процесінде әрбір оқушының белсенділігін арттыруда оқу әрекетін жекешелендіру мүмкіндіктерін қарастырды. Басқалары бұл міндетті шешуде оқытудың жаңа технологияларын қарастырды. Д. И. Менделеевтің периодтық заңының ашылуы және оның негізінде химиялық элементтердің жүйеленуіне 140 жылдан астам уақыт өтті. Сол кезден бастап заттар туралы ғылым алға қарай өте тез дамыда және атомның негізіне терең енді. Адам атомның табиғатын қанша көп білгенімен, Д. И. Менделеевтің ашулары заттардың дамуы мен эволюция заңдылықтарын білуге бірінші қадам жасады [1] .
Периодық жүйе арқылы табиғатта кездесетін элементтер периодтық заңға бағынатыны жайлы мағлұмат алуға болады. Тақырыпты оқытудың басты тәрбиелік мәні -периодтық заң мен химиялық элементтердің период-тық жүйесін түсіну нәтижесінде химиялық элементтер жайлы білім қоры-тындыланады; түсіндірумен қатар теориялық білімге алдын-ала болжам жасалады; білімге қойылатын талаптың тәжірибеде анықталуында даму жолдарының нәтижесі айқындалады [2] .
Мектеп химия курсы 5 теориялық концепцияларға негізделген. Олар: атом-молекулалық ілім;
- периодтық заң, Д. И. Менделеевтің химиялық элементтердің период-тық жүйесі және зат құрылысының теориясы;
- химиялық реакциялардың түзілу және жүру заңдылықтары
- электролиттік диссоция теориясы;
- қазіргі заманның органикалық затттар құрылыс теориясы.
Диплом жұмысының мақсаты:
Периодтық заң, Д. И. Менделеевтің химиялық элементтердің периодтық жүйесі және зат құрылысы теориясының орта мектеп курсында орны мен маңызын анықтау және қазіргі заманға сай әдістемелік нұсқауларды құру.
Диплом жұмысының міндеттері :
- периодтық заң, Д. И. Менделеевтің химиялық элементтердің период-тық жүйесінің ашылу тарихы, құрылуына және дамуына әдістемелік шолу;
- мектеп химия курсында периодтық заң, Д. И. Менделеевтің химиялық элементтердің периодтық жүйесінің теориялық концепциясының мақсаты, орны, маңызы және міндеттері;
- қазіргі замандағы тақырыпқа әдістемелік еңбектерге шолу;
- «Периодтық заңның ашылу тарихы» сабақты ақпаратты коммуни-кативті технология негізінде әдістемелік жоспарды жасау;
- ақпараттық технология негізінде бақылау тапсырмаларын жасау.
Зерттеудiң ғылыми әдiстерi : Зерттеу бағыты бойынша ғылыми-әдістемелік, психологиялық, педагогикалық әдебиеттерді талдау; оқушылар-мен, мұғалімдермен, мектеп басшыларымен, олардың арасында сауалнамалар жүргізу; оқу үрдісіне енгізу жолдарын ұсыну.
Зерттеу объектісі: Бейорганикалық химия курсында Д. И. Менделеевтің периодтық жүйесі.
Зерттеу пәні: Бейорганикалық химия сабақтарында оқушылардың ойлау қабілетін, логикалық пікірлеу, шығармашылық қабілетін дамыту жолдары.
Зерттеудің ғылыми жаңалығы:
Орта мектепте бейорганикалық химияны оқыту үрдісінде ұжымдық оқыту әдісі пайдаланылса, онда оқушылардың білім көрсеткіштері жоғарылап, химия пәніне деген қызығушылықтары оянып, танымдық белсенділіктері артады және сабаққа деген ынтасы жақсарады.
Диплом жұмысының құрылымы кіріспеден, екі бөлімнен, қорытындыдан, пайдаланылған әдебиеттер тізімі мен қосымшадан тұрады.
- ПЕРИОДТЫҚ ЖҮЙЕ ЖӘНЕ ПЕРИОДТЫҚ ЗАҢ
1. 1 Элементтердің Д. И. Менделеевке дейінгі және қазіргі заманғы классификациясы
Элементтердің периодтық жүйесі бейорганикалық химия саласындағы алуан түрлі тәжірибелік материалдарды бір жүйеге келтіріп, өзара біріне-бірін ұштастырып зерттеуге мүмкіншілік береді. Сөз жоқ, химиктің квалифи-кациялық деңгейі химиялық байланыс табиғатының өзгеруінің жалпы заңды-лықтарын, химиялық, кристалохимиялық құрылысты, заттардың қасиеттерін, периодтық жүйенің тәртіптерімен жұптастыра білуімен, шығармашылық тұрғыда қолдана алатындығымен анықталады.
Периодтық жүйені атомдардың электрондық құрылысының қазіргі уақыттағы квантты-механикалық көзқарас тұрғысынан зерттеп, талдауға бо-лады. Осындай қарастыруда элементтердің қасиеттері өзгерісінің тек жалпы заңдылықтары ғана анықталмай, сонымен қатар, екінші және ішкі, горизон-тальды, диагональды өзгерістерді түсіндіре алатын нәзік қасиеттерді де анықтауға болады [3] .
Химиялық элементтердің саны көбейген сайын, олар жайындағы білім көбейіп, оларды бір тәртіпке келтіріп жинақтау керек бола берді.
Элементтердің қасиеттерін салыстырып ерте уақыттан-ақ металл және бейметалл деп екіге бөлетін. Бұл ірі бөлу химиктерді қанағаттандыра алмады, сондықтан элементтердің бір қасиетіне сүйеніп, элементтерді ұсағырақ топқа бөлу қажет болды.
1817 жылы неміс химигі Деберейнер өзіне белгілі элементтердің қасиеті ұқсастарын үш-үштен тіркестіріп, триада деп ат беріп, оларды байланыстыратын математикалық заңдылық тапқан:
Li Ca P S Cl
Na Sr As Se Br
K Ba Sb Te I
әрбір триаданың ортаңғы элементінің атомдық массасы шеткілерінің атомдық массаларының арифметикалық орта санына тең болады:
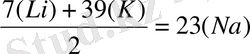 ↓
↓
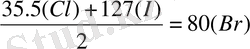
Ол уақыттағы белгілі элементтердің барлығы мұндай триада түзе алмады.
1863 жылы француз ғалымы Бегье де Шанкуртуа 50 элементтің тізімін, атомдық массаларына сәйкес, белгілі масштаб бойынша цилиндрдің сыртына винт (бұранда) сызығының бойымен орналастырған. Сонда ұқсас элемент-тердің көбі бірінің астына бірі келген[4] .
1864 жылы ағылшын ғалымы Ньюлендс, элементтерді атомдық масса-ларының өсу ретімен орналастырған, сонда әрбір сегізінші элемент бірінші элементтің қасиетін қайталайтындығын байқаған. Бұл музыкада сегізінші нотаның қайталайтындығына ұқсас болған соң Ньюлендс оны «октава заңы» деп атаған. Бірнеше «октаваларды» келтірейік:
H Li Be B C N O
F Na Mg Al Si P S
Cl K Ca Ti Cr Mn Fe
Co(Ni) Cu V Zn In As Se
Ньюлендстің кестесінде қателіктер, қайшылықтар бар. Кей орында екі элементтен (Со, Nі) тұр, Ti, Cr, V, Mn тағы басқалар өз орындарында емес, жоқ элементтерге орын қалдырылмаған т. б. Бірақ атомдық масса өскен сайын химиялық қасиет периодты түрде өзгеретіндігін көрсетуі дұрыс пікір.
Сол 1864жылы неміс ғалымы Лотар Мейер 28 элементтен тұратын кестені жариялады. Мейердің негізге алғаны элементтердің атомдық масса-лары мен валенттігі (Кесте 1) .
Кесте 1
Мейердің элементтердің атомдық массалары мен валенттігі
-
C
Si
-
Sn
Rb
-
N
P
As
Sb
Bi
-
O
S
Te
Se
Bi
-
F
Cl
Br
I
-
Li
Na
K
Rb
Cs
Ti
Be
Mg
Ca
Sr
Ba
-
Л. Мейер бұл элементтердің атомдық массаларының айырымын, да есептеген атомдық көлемдердің атомдық массаға периодты түрде байланыс-ты екенін де көрген, бірақ одан ешбір керекті қорытынды шығаруға батылы бармаған. Л. Мейер де периодтық заңды қолына ұстап отырып, уысынан шығарып алған. Д. И. Менделеевке дейінгі химиялық элементтерді классифи-кациялаушы лардың барлығы бір топтағы элементтердің арасындағы кейбір ұқсастықты ғана көрген, ал топтардың да арасында байланыс барлығын, олар барлығы бүтін жүйе екендігін көре алмаған. Ең алғаш 1869жылы, одан кейін 1870, 1871жылдары Д. И. Менделеев периодтық жүйе мен периодтық заңды ашқандығын орыс және шетел тілдер-інде жариялайды. Бірақ бұған ол кезде шетел ғалымдары көңіл бөлмеген.
Осыдан біраз жылдар өткенннен кейін Д. И. Менделеев ашылуы керек деп болжап айтқан элементтерінен Ga, Sc, Ge және инертті газдар ашылып, периодтық заң үлкен ғылыми табыс екендігін жер жүзі ғалымдары танумен қабат, кейбір шетелдіктер бұл заңның ашылу приоритетіне қол сұға бас-тайды. Периодтық заңды ашу приоритетін француздар - Бегье де Шанкур-туаға, ағылшындар - Ньюлендске, немістер - Л. Мейерге бермек болды. Бірақ жер жүзілік химиялық әдебиетте бұл заңды ашқан Д. И. Менделеев деп танылды. Шетел тәжірибелерінің бірі-халықаралық деңгейде қабылданған периодтық кестені оқыту. Он тоғызыншы ғасырдың басынан бастап элемент-тердің химиялық және физикалық қасиеттері мәселесімен химик-ғалымдар айналысқан. Элементтердің химиялық қасиеттері жағынан топтастыру жұм-ыстары Л. Мейер және Д. И. Менделеев тарапынан 1869жылы басталған[5] .
Мектептерде оқытылған Д. И. Менделеевтің периодтық жүйесі бойынша қабылданған кестеде элемент топтарының астында сол элементтердің жоғары оксидті қосылыстарының формулалары (RO, R 2 О, RО 2 ) көрсетілген, халықаралық қолданылымдағы кестеде бұл көрсетілмеген. Оның мақсаты элементтер және олардың қосылыстары жайлы мағлұмат алу үшін период-тық заңның маңызын түсіну қажеттілігі.
Д. И. Менделеевтің кестесінде қатар мен периодтар бірге көрсетілген. Жұп қатарға тек қана металдар орналасады. Тақ қатарға металдар мен бірге бейметалдар да кіреді. Ал халықаралық кестеде периодтың өзі тек қана бір қатармен көрсетіледі, шатастыруға мүмкіндік берілмейді. Д. И. Менделеевтің периодтық жүйесі бойынша 7-период 10-қатарда көрсетілген. 4-ші период 4 пен 5-ші қатарда, 5-ші период 6, 7-ші қатарда және 6-шы период 8, 9-шы қатарда тұрады. Сонда 4, 5, 6 периодтар екі қатардан көрсетіліп тұр. Халық-аралық жүйеде 7-периодтың өзі 7-ші қатар, яғни әр периодқа бір қатардан элементтер тізілген. Бұл оқушылардың сабақты түсінуіне жеңіл болады. Топтарға келетін болсақ, Д. И. Менделеевтің периодтық кестесінде 8 топ деп көрсетілен, бірақ халықаралық жүйеде 8 А және 8 Б топтары боп 16 топтан тұрады [6] .
Химиялық элементтердің периодтық жүйесінің ашылу тарихы.
Периодтық жүйенің ашылуы жалпы химия ілімінің дамуымен тығыз байланысты. Жүйенің қажеттілігі уақыттың қойылатын талаптарымен сәйкес баяндалады десе де болады. Химиялық элементтерді жіктеу идеялары «ауада жүреді». Бірақ, көптеген ұсынылған ойлар орталық заңдылыққа сәйкес кел-меді. Сол кездегі белгілі 63 элементті бір жүйеге келтіру және белгісіз эле-менттерді осы қатарға ретімен орналастырып белгілі заңдылық ашу Д. И. Менделеевтің үлкен тапқырлығы еді.
Сонымен қатар, ашылған заңның дұрыстығын толық мойындау үшін және элементтер қатарының атомдық массаларының өзгеруіне сәйкес, сол кездегі белгісіз элементтердің болуын және олардың ашылуын күтуге аса ғылыми батылдық пен ерлік қажет болды (1871ж 17 элементтің орнын ауыс-тырды) . Д. И. Менделеев келесі элементтер қатарының бар болуын болжады: экабор (галлий), экаалюминий (скандий), экакремний (германий), экамар-ганец (рений) және басқалары. Элементтер туралы мәліметтер жинақталды. Химиялық элементтерді жіктеуге және оларды қасиеттеріне сәйкес жіктеу арқылы әртүрлі топтарға бөлу мүмкіншілігі туды [7] .
Жай денелердің жүйесін құруда үлкен тарихи-химиялық маңызы бар бірінші Лавуазьенің кестесі болды (Франция 1789ж) ол өзінің «химияның элементарлы курсы» кітабында «жай денелер кестесін» келтірді. Ондағы барлық белгілі жай денелер олардың химиялық қасиеттеріне сай, 4 топқа бөлінді. Лавуазье бойынша жай заттар - ол элементтер, металл еместер мен әлі белгісіз қышқылдардың радикалдары және жерлер (сілтілік жер метал-дар) . Бұл кесте - сол кездегі белгілі 23 элементтің бірінші жүйесі.
Швед химигі Я. Берцелиус 1808ж Барлық элементтерді 2 топқа бөлді: металдар, металеместер деп және химияға «металлоид» деген ұғымды енгізді. Дальтон химияға «атом» және «атомдық салмақ» түсінігін енгіз-геннен кейін, 1815-1816жылдары заттардың атомдық салмағының еселісіне негіз-делген біріншілік материя туралы Праут гипотезасы пайда болды. Басқа барлық заттардың құрылуына қажетті біріншілік материя ретінде Праут сутекті атады. Праут гипотезасы үлкен қызығушылық туғызды және бұл гипотезадан элементтер жүйесі оңай шыққандай көрінді. Бірақ та көптеген ұсыныстарға және атомдық салмақтың анықталуына қарамай, біршама атомдық салмақтар сутек арқылы дәлелденбей қалды.
1814 жылдан бастап элементтердің химиялық қасиеттеріне байланысты жіктелу жүйесімен Германиядағы алғаш атомистердің бірі Деберейнер айналысты. Ол 1816ж өзінің триадалық реттік деген алғашқы жүйесін ұсын-ды. Оның жүйесі 52 элементтен тұрды. Атомдық массаға және химиялық қасиеттерінің арасындағы байланысқа сүйене отырып, ұқсас элементтерді триадаға біріктірді (Кесте 2) .
Кесте 2
Триадалық реттілік
Ортаңғы элементтің атомдық массасы көрші элементтің атомдық масса-сының жартысына тең екені есеппен анықталады:
 А(б) =
А(б) =
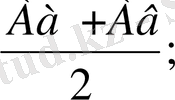 A(Na)
A(Na)
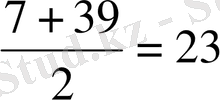
Триада ережесіне P мен As, Sb және Bi, Zn мен Cd элементтері ара-сындағы байланыстылық сәйкес келмейді. P, As, Sb, Bi арасындағы ерекше-ліктерді де байқауға болмады. Кейінірек элементтердің атомдық салмағының мөлшерін салыстыруда басқа да әдістер қолданылды. Петтенкоффер 1850ж кейбір элементтердің атомдық салмағы бір-біріне 8-ге еселі деген ұғымды енгізді. Элементтердің атомдық массалары және эквиваленті арасындағы сандық ара қатынасының талдауын 1851ж Дюма және 1857ж Лансен ұсынды. Дюма ұқсас элементтер тобындағы атомдық салмақты есептеу үшін жай формулаларды ұсынды. Ленсен 20 триада тізімін құрастырып, көптеген элементтердің атомдық салмағын анықтады.
Д. И. Менделеев, Дюма мен Ленсеннің салыстыруын жоғары бағалады. Оның өзінің сөзі бойынша: «маған дейінгі элементтердің атомдық салма-ғының мөлшерін салыстырумен айналысқан барлық ғалымдардың арасында екі ғалымды Ленсен мен Дюманы атауға міндеттімін. Олардың зерттеулері мені нақты заңды ашуға әкелді».
Химиялық элементтерді жіктеу үшін триада және тетраданы қолдану ұмтылыстары басқа да ғалымдармен байланысты: Кремерс (1852), Кук (1854) және тағы да басқалары.
ХІХғ 60-жылдарында химиялық ұқсас элементтер топтары арасындағы салыстыру жұмыстары әрі қарай жалғасты.
Егер хронология жағынан қарайтын болса, барлық 63 белгілі элементті қамтитын жіктеудің алғашқы кестесін 1862ж француз ғалымы Шанкуртуа ұсынды. Ол барлық элементтерді цилиндрдің бетіне спираль бойынша («Шанкуртуаның винттік сызығы») 16 бөлімге бөліп атомдық массаларының өсуіне сәйкес орналастырады(Сурет 1) .
Бұл жағдайда химиялық ұқсас элементтер бір-бірінің астына орнала-сады. Ол атомдық масса мен химиялық қасиеттер байланысын алғаш рет көрсетті.
Бірақ бұл кестенің өзіндік ерекшеліктері де болды, бір сызықтың бойында қасиеттері әртүрлі элементтер де орналасты (O, S, Ti, Li, Na, K, Mn) . Бұл жіктеу, алғаш рет 1893-1894 жылы жарыққа шықты және жақтаушылары аса көп болмады. Көп жылдар бойы (1857жылдан 1868ж дейін) Одлингтің химиялық элементтердің әртүрлі вариантты кестелері жарыққа шықты. Одлинг Деберейнер принцпін сақтауға тырысып, өзінің кестелерін, түсін-діруге тырыспады, және ешқандай қорытынды жасамады. 1864жылы неміс химигінің (Лотар Мейер) жұмысы жарық көрді.
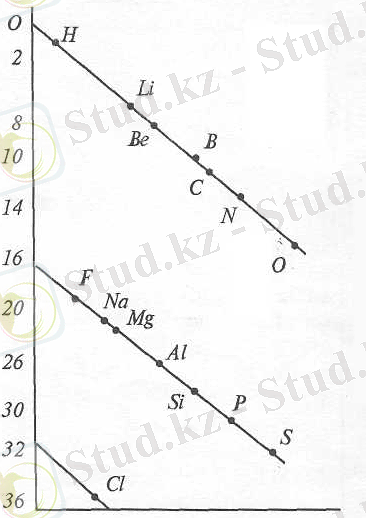
Сурет 1. Шанкуртуаның винттік сызығы
Ол сутек элементтерінің валенттілігіне және олардың атомдық масса-ларына сәйкес 44 элементті (ол кезде белгілі 62 элементтен) 6 топқа жіктеді. Мейер өзінің жіктеуі бойынша «атомдық салмақтың сандық мөлшерінде белгілі байланыстықтың болуына күмандануға болмайды», деп жазды. Бірақ та Мейер заңдылықтың барлық жүйелерін толығырақ және тереңірек анықтай алмады (Кесте 3) .
Кесте 3
Мейердің кестесі
4-атом
айырмашылығы
16
C(12)
16
Si(28)
16
_
16
Sn(176. 6)
16
Pb(207)
N (14)
P (31)
As (75)
Sb
(120. 6)
Bi (208)
O (16)
S (32)
Se (79)
Te
(128. 3)
F(19, 0)
Cl(35, 5)
Br(80)
…
(126, 8)
Li (7)
Na (23)
K(39, 1)
Rb(85)
Cs
(133)
Tl(204)
Be (9. 3)
Mg(24)
Ca(40)
Sr
(87, 6)
Ba(137)
Ағылшын ғалымы Ньюлендс (1863-1865 жылдары) элементтерді атом-дық массаларының өсу ретімен орналастырғанда әр 8 элементтен кейін олар-дың қасиеттері периодтық түрде өзгеретінін айқындады. Ньюлендс бұл заң-дылықты музыкадағы октава жіктеулігімен салыстырып, октава заңы деп атады (Кесте 4) .
Кесте 4
Ньюлендстің октавалары
Ньюлендс сол кезеңде табылған атомдық массаларға ешқандай күмән келтірмей, барлық атомдық массалар дұрыс деп есептеп, өзінің октавалық қатарын құрды. Бірақ, үшінші қатардан бастап Ньюлендс бір топқа әртүрлі элементтерді орналастыруға мұқтаж болды. Әрине, Ньюлендстің осы жүйесі көптеген тәжірибелік деректерге қайшы келді. Сондықтан оның 1866 ж. Лондонның химилық қоғамында жасалған баяндамасында октавалық жүйе қатты сынға алынды. Осы жиында профессор Фостер мынадай сұрақ қойды: сіз химиялық элементтерді алфавиттік ретпен қойғанда басқа жаңа заңдылықтарды байқамадыңыз ба? Осындай сыннан кейін Ньюлендс өзінің жұмысын жарыққа шығармады. Бірақ Ньюлендстің ғылыми жұмыстары жоғары бағаланды, 1887жылы оны ғылыми жұмыстары үшін Деви медалімен марапатталды. Ньюлендс бірінші болып, химиялық элементтерді атомдық массалары өсу ретімен орналастырғанын және осы реттікпен химиялық қасиеттерінің арасындағы байланыстылықты ашқанын атап өту керек. Ньюлендс элементтердің реттік нөмірі деген түсінікті бірінші болып химияға енгізді.
Д. И. Менделеевке дейін химиялық элементтерді классификациялау тек тәжірибелік деңгейде ғана жүрді, элементтердің жалпы заңдылықтары ашылмады.
Д. И. Менделеевтің жасаған периодтық жүйенің құрылуы және дамуы.
Д. И. Менделеев бұл мәселені шешуге басқа ғалымдарға қарағанда мүлдем басқа жолмен келді. Зерттеулерді химиялық элементтер арасында заңдылықты байланыс және өзара тәуелділік болу керек деген толық сеніммен бастады. Ол бұрынғы жіктеулерді талдай отырып, олардың негіз-інде - жалпы нұсқа жоқ екендігін дәлелдеді (Сурет 2) .

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz