Бұқа шәуетіндегі спермалардың фертильділігін зертханалық молекулярлық-генетикалық әдістермен бағалау


Қазақстан Республикасы Ауылшаруашылық министрлігі
Қазақ Ұлттық аграрлық университеті
Коммерциялық емес акционерлік қоғамы
«Акушерлік, хирургия және өсіп - өну биотехнологиясы» кафедрасы
Тақырыбы: Спермилердің фертильділігін анықтаудың молекулярлық-генетикалық әдістері
Қабылдаған:
Орындаған:
Тобы:
Алматы 2019ж
Жоспар:
1. Кіріспе
1. 1. Спермилер туралы түсінік
2. Негізгі бөлім
2. 1. Спермилердің фертильділін анықтау әдістері
2. 2. Спермий ядросындағы протамин мен гистон мөлшері
2. 3. ДНҚ фрагментациясын анықтау
2. 4. Спермидегі хроматин жағдайын бағалау
3. Қорытынды
4. Пайдаланылған әдебиеттер тізімі
- КІРІСПЕ
1. 1. Шәует - спермийлер мен плазманың қосындысы . Спермий дегеніміз эякуляция кезінде бөлініп шығатын сұйықтық. Спермийлер - төрт бөліктен тұрады - басы, мойыны, денесі және құйрығы. Спермийлер аналық торша клеткасынан 2 есе кем. Бұқада, қошқарда спермийлердің ұзындығы 75-80мкм, текеде 60-65мкм, айғырда 50-60мкм. Спермийлердің басы негізінен нуклеопротеидтерден тұрады, ДНҚ және жай ақ зат гистоннан тұрады. Спермий басындағы ДНҚ мөлшері тұрақты болады және оның мөлшері азайғанда бедеулік пайда болады. Спермийлердің мойыны өте қысқа, ал денесі мен құйрығы жай зат пен липидтерден тұрады.
Спермийлерге тән қасиет - ол олардың қозғалыста болуы. Спермийлер қалыпты жағдайда тура, үдемелі қозғалыспен қозғалады, ал әлсіреген спермийлер манеждік немесе тербелмелі қозғалыспен қозғалады, яғни бұлар пайдалануға жарамсыз болып табылады. Спермийлердің жағдайы қоршаған ортаға байланысты. Спермийлердің қозғалыс қарқындылығы өзгеріп тұрады, ол 1 минутта 1, 9-15, 4мм болады. Мысалы, бұқа спермийі 1 минутта 4мм, қошқар - 4, 6мм, айғыр - 5, 22мм, төбетте - 2, 5мм, қораз - 1, 02мм жол жүріп өтеді екен. Спермийлердің жағдайы қоршаған орта жағдайына байланысты спермийлердің қарқындылығы өзгеріп тұрады, ол 1 минутта 1, 9-15, 4см болады.
Ортаның реакциясы немесе сутегі иондарының концентрациясы спермийлердің өмір - тіршілігіне біршама әсер етеді. Спермийлер үшін ең қолайлы ортаның реакциясы 6, 9-7, 2 аралығында болуы керек. Егер ол -тен көрсеткіш 6-дан төмен болса немесе 7, 5-тен жоғары болса, спермийлер өледі, әсіресе, органикалық қышқылдар өте зиянды. Сапалы шәуеттің рН реакциясы бейтарапты деңгейде біршама уақыт өзгермей тұра алады, оған шәуеттің химиялық құрамы көп көмектеседі.
Спермийлер аттас теріс зарядты болғандықтан бір-біріне жабыспайды, физика заңына сәйкес аттас зарядтар бірін-бірі тебеді. Спермийлердің өзіне тән теріс зарядтарын жоғалтып, бір-біріне жабысып қалуын спермийлердің агглютинациясы деп атайды.
2. НЕГІЗГІ БӨЛІМ
2. 1. Спермийлердің ұрықтану қабылеті (фертилдігі) - аталықтардың спермийлерінің ұрықтану қабылетін көрсететін көрсеткіш, анықтаманың шығу жолы «фертильность» ағылшын тіліндегі «fertilization» (ұрықтану) сөзінен алынған. Фертильділік (латынша fertilis - ұрықтылық, тұқымдылық, төлдегіштік) дегеніміз - жыныстық тұрғыдан жетілген ағзаның өмірге ұрпақ әкелуге қабілеттілігі. Аталық малдың фертильділігі дегеніміз өмірге қабілетті ұрпақ қалдыра білу қабіліті. Фертильділік бір жағынан спермалардың саны мен сапасын анықтаса, е кінші жағынан генетикалық материал болып саналады.
Дәл қазіргі уақытта аталық малдардың фертильділігін анықтаудың хроматин структурасынан анализ алу арқылы жасалатын әдәсі бар, бірақ бұл әіс спермилердің фертильділігін анықтауда төмен нәтиже береді. Әдебиеттік мәліметтер сүтті сиырларды қолдан ұрытандыру олардың көбею жағдайына ғана емес аталық малдың ұрықтандыра алу қабілеттіліне де байланысты. Аталық малдардың 40%-ға жуығы төмен фертильділікті көрсетеді, аз бөлігі бедеу. Осыған байланысты спермилердің фертильділін анықтау үлкен экономикалық және биологиялық мәнге ие.
Спермилердің фертильділігін анықтау эксперименті 201 голштинг пародалы бұқаларға қолдан ұрықтандыру орталығы болып саналатын Испанияда 2 әдіспен жасалған, олар спермилердің ДНҚ фрагментациясы (криоконсервіленген сперми анализі - SDF-6, 37°С - та 6 сағаттық инкубация дан кейінгі анализ - SDF -6) және спермилердің хроматин депрессиясия тесті (SCD) . Бұқалардың SDF-0 ДНҚ фрагментациясы орташа 3. 60, SDF -6 тербеліспен 1-ден - 20. 40 орташа есеппен 3. 60-ты құраған. Кез келген деформация немесе спермидегі ДНҚ хроматин ауытқуы технологиялық процеске (спермилер криконсервациясы, сексирленген сперми алу технологиясы) кері әсер етуімен ұрықтануға, сиыр төлінің эмбриональдық сатыда өлімге ұшырауына әкеліп соғады. Спермилер криконсервациясы мен сексирленген сперми алу кезіндегі ДНҚ спермиіне қажет емес кері әсерді анықтау үшін TUNEL (terminal deoxynucleotidyl transferasa-mediated dUTP nick and labeling) . TUNEL анализіне материал ретінде жаңадан алынған Жапондық породалы 2 қара бұқа және 34 голштинск породалы бұқаның қатырылған шәуеті алынған. Эксперименттен алынған нәтиже Жапондық породалы 2 қара бұқа спермидің орташа TUNEL индексі 4, 7% және 55, 7%, ал голштинск породасының TUNEL индексі 4, 9% және 39, 5% Спермилердің TUNEL индексінде әлсіз корреляциялық теріс байланысты голштинск породалары бұқалар көрсетті (Р<0, 05), авторлар сондықтан спермилердің сапасын қосымша анықтауы үшін TUNEL индексін қолдануды ұсынады.
Медицинада еркектердің ұрықтандыру қабілеттілігін бағалау үшін ДНҚ фрагментация, спермадағы ақуыз мөлшерін анықтау сияқты молекула-генетикалық әдістер қолданылады. Көрсетілген әдістер еркектердің бедеулігін жетілген спермилердің түзілу процесімен байланысын анықтайды.
2. 2. Спермийдегі протамин мен гистон мөлшері. Гистондардың протаминге айналуы спермилердің түзілуінде маңызды қадам екені белгілі. Қалыпты жағдайдажетілген сперми хроматині 85% протамин және 15% гистоннан тұрса, жетілмеген хроматин 15%-данкөп гистонды құрайды. Протамин жоғары қабілетті протеин, ядро көп аргинин мен цистеиннің аз мөлшерде - цистинді құрайды. Спермидегі ақуызды анықтау әдісі аминқышқылдарына бай протеинді, гистонды лизинмен қанық көк түске «AnilineBlue» бояуымен (сперидің басы қанық көк түске боялады), ал жетілген спермилердің ядросы (протамин) аминқышқылдарына, аргенин мен цистинге бай болғандықтан алқызыл (розовый) түске боялады (Сурет - 1) . Дәл қазіргі уақытта спермилердің сапасын анықтаудың дәстүрлі әдістері: спермилерің концентрациясын, морфологиясын, спермилердің қозғалғыштығын анықтау спермилердің фертильділігін анықтағанда әрқашанда нақты әдіс болып табылмайды. Заманауи молекула-генетикалық әдістермен ДНҚ-фрагментация (Sperm LNA fragmentation, SDF), хроматин спермиінің депрессия тесті (Sperm chromation dispersion test, SCD) сияқты спермилердің ұрықтандыру қабілетін анықтау әдістері қолдан ұрықтандыру нәтижелілігін көтеруге септігін тигізеді.
Мөлшерде лизин амин қышқылы болатын гистон протеині «Aniline Blue» бояуымен бояғанда (спермийлердің бастары қаныққан көк түске) қаныққан көк түске боялады, ал құрамында аргинин және цистеин аминқышқылдары көп протамин протеині күлгін түске боялады. Аталған әдіс жиі медицинада, ер адамдардың шәуетіндегі спермилер ядросындағы протамин және гистон протеиндерінің мөлшерін анықтауға кең қолданылады. Әдіс жедел жүргізіледі, ер адамға байланысты болған бедеулікке балау жасауда аса маңызды зерттеу тәсілі болып табылады және спермийлер түзілуіне байланысты болған бедеулікті анықтауға мүмкіндік береді. Жапон ғалымдары сиырлардың көбею қызметі мен TNFα (tumor necrosis factor - ісік некрозы факторы) локусы бойынша генетикалық варианттары, аллельдерідің арасындағы байланысты зерттеген және осы ген аллельдерінің сиырлардың репродуктивтік қызметі, иммундық деңгейі арасындағы корреляцияны анықтаған. Зерттеу нәтижесінде тәжірибе тобындағы сиырларда TNFα генінің промоторлық және экзондық бөліктерінде кездесетін, келесі генетикалық , промоторлық және экзондық бөліктеріндеA/A, A/G, G/G және T/T, T/C, C/C бар екенін дәлелдеген. Сиырларда TNFαлокусы бойынша генетикалық варианттар мен осы ген аллельдерінің арасында сиырлар туғаннан кейін мерзім мен бірінші овуляция аралығында, сиырлардың иммундық жүйесі арасында байланыстар анықталған. ДНҚ полиморфизмі TNFαпромоторлық және экзондық бөліктерінде кездескен. Молекулярлық-генетикалық зерттеулер нәтижесі, аталған геннің экспрессия деңгейі осы локус бойынша сиырларды генотиптеу практикалық тұрғыдан маңызды екенін көрсеткен. Сиырлардың генотипін анықтауға полимераздық тізбек реакциясы (ПТР), рестриктелган фрагменттер ұзындықтарының полиморфизмі (РФҰП) тәсілдері қолданылған. Арнайы әдебиетке жүргізілген шолу көрсеткеніндей, сиырлардың жыныстық қызметін болжау және оңтайлы генотипті төлдер алу үшін ДНҚ маркерлерін, соның ішінде TNFα, GDF 9 локустары бойынша генотип анықтаудың маңызы отандық ғалымдардың зерттеулерінде көрсетілген. Қазіргі таңда, аналық жануарларда репродуктивтік қызметті (фолликулогенез, овуляция, доминатты фолликулдер даму ерекшеліктері) реттейтін гендердің маңызы үлкен. Зерттеу жұмыстарының мақсаты - бұқа шәуетіндегі спермийлердің ұрықтану қабылетін in vitro жағдайында молекулярлық-генетикалық әдістермен балау, асыл тұқымды сиырларды TNFα локусы бойынша генотиптеу арқылы олардың репродуктивтік қызметіне болжау жасау.
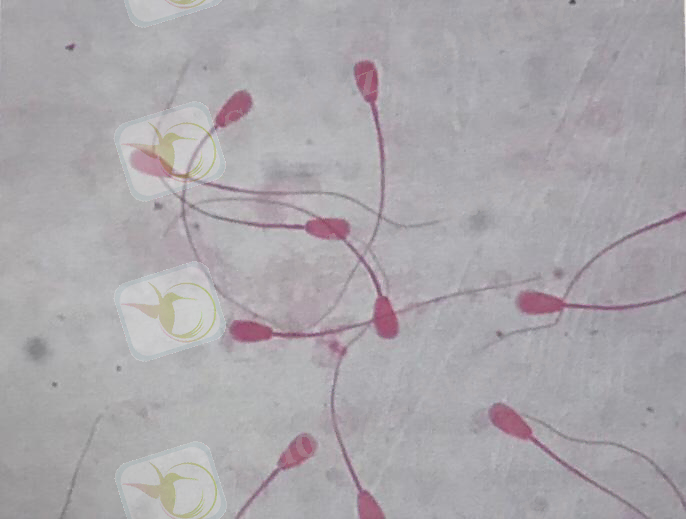
Сурет - 1. Аталық бұқалардың спермийлеріндегі протамин мен гистон мөлшерін «Aniline Blue» бояуы көмегімен анықтау, алқызыл түске боялғандары пісіп жетілген спермийлер, 100 есе ұлғайту.
Аталған әдіс ябролық белокты анықтау спермийдегі физиологиялық жетілгендерін анықтап, ұрықтың ұрықтандыруға дайындығын анықтауға мүмкіндік береді. Себебі, спермийдің ұрықтандыруға дайындығы ондағы ядролық белоктың, яғни протамин мен гистон мөлшерінің ұлғаюы спермийлер әлі жетілмеген, ұрықтандыруға жағдайы жоқ екеніін көрсетеді. Спермийлердегі ДНҚ хроматинмен жабылған және спермийлердегі гистон деңгейін арттыру хроматиннің бірізділігінің жарылуына және ДНҚ фрагменттеуіне әкеліп соғады.
Жұмыс кезінде бұқалар мен еркектердің фертильділігі мен субфертильділігі идентификациясын саралау үшін спермиді бағалайтын тура және кері әдістер бар. Олар кері әдістер SCSA (сперматозоид хроматинінің структуралық анализі), акридин сарғышымен бояу әдістері жатса, тура әдістерге COMET, SCD (Sperm chromatin dispersion, ), HALO, AOT (Acridine orange test), TUNEL сияқты коммерциялық потенциалдық әдістер қолданылады. COMET, SCSA әістері сперматозоидтағы ДНҚ дефектін (ауытқуын) анықтау үшін қолданылатын заманауи әдістер болып саналады. SCSA әдісінің негізгі мағынасы аққан цитометри арқылы хроматин жағдайы мен ДНҚ спермиінің бүтіндігін, боялған ДНҚ (акридинді бояумен) лазерлік сәуле арқылы лазерлік жарыққа өтіп, бояу флуросцентті жарықпен түсті анықтауға қолданылады.
1998 жылы COMET және 2003жылы SCD (Sperm chromatin dispersion) жасалған тес системалар жай болы саналады, яғни ол цитометрді қажет етпейді, жарық микроскоп қолданылып 50-200 сперми бір анализге жіберіледі. Бірақ алынған статистикалық мәліметтер дәл болмауы мүмкін. Айта кету керек аталған әдістер SCSA (сперматозоид хроматинінің структуралық анализі), акридин сарғышымен боя әдістері, COMET, SCD (Sperm chromatin dispersion, ), HALO, AOT (Acridine orange test), TUNEL әдістері сезімтал, арнайы, хроматин жағдайын және спермилердің ДНҚ фрагментациясын анықтауға мүмкіндік береді.
2. 3. ДНҚ фрагментациясын анықтау . ДНҚ фрагментациясы - спермийлердің ұрықтандыру қабылетін бағалайтын көрсеткіш, аталық жануарлардың және олардың спермийлерінің ұрықтандыру қабылетін көрсететін аса маңызды бағалау. ДНҚ молекуласының хроматинінің бүтіндігі ұрықтану кезінде генетикалық материалдарды беруде аса маңызды көрсеткіш. Мұндай зақымданулар көп болған сайын генетикалық материалдың бүтінділігі төмен болып, ұрықтандыру қабілеті нашарлайды. ДНҚ фрагментациясының болу себебі - түзілу кезіндегі ауытқу және сперматозоиттың ескіруі, апаптоз. 30% аталық малдың бедеулігі ДНҚ фрагментация әсерінен болады. ДНҚ фрагментациясы спермилерге қалай әсер етеді? Жұмыртқалықты ұрықтандыру қабілеті төмендейі, ұрықтансада түсік тасталады, қолдан ұрықтандырғанда төл дамуында ауытқу болады. ДНҚ фрагментациясын анықтау үшін қатырылған 100мл спермиге 400мкл физиологиялық ерітінді қосып 2-3минут 2000 айналымда центрифугалаймыз. Осындай әдіспен спермиді сұйылтамыз, себебі соңғы концентрация 1ми спермиде 40-60млн спермиді құрауы үшін. Содан соң 5 мл сұйықты төгіп тастап, микропипетка көмегімен 5мкл сұйықты шыны әйнекшеге салып, 5-7минут ауада кептірірп жағынды жасадық. Заттық әйнекшені горизонтальды жағдайда қойып, жаындыға 1мл фиксирленген ерітінді қосамыз. 5минут өткеннен кейін фиксирленген ерітіндіні төгіп тастап, вертикальдық жағдайдда ұстап дистилденген суда бекіткіштен шаямыз. Ауада жағындыны кептіріп 5мин №1 бояумен 1мл мөлшерде бояймыз, ол жағындыны толық жауып тұруы керек. Содан соң жағындыны стақанда дистилденген суда бояғыштан шаямыз ауада кептіріп, осы процеураны №2 бояғышпен 2минуттық экспозиицияда жасаймыз.
ДНҚ фагментациясы дәрежесі протокол бойынша жүргізіледі. Агарозалы пробирканы 15-20минут су монасына (+70°) қойып, одан кейін пробирканы 5минут +37°С термостатқа қоямыз, параллельді түрде сперми үлгісін жасап концентрациясын 10-15млн спермиге 1мл физиологиялық ерітінді қосу арқылы 600мкл сперми қосып жеткіземіз де термостатқа қойып пипетка көмегімен 15-20 тамшы агарозалы сперми қосындысын заттық әйнекшеге орналастырып, көпіршіктер пайда болмас үшін тоңазытқышқа 5 минут қою қажет. Уақыт өткен соң байыппен бетіндегі шыныны алу керек. Заттық шыныға 8-10мл 1 реагент қосамыз 7минут экспозицияда. 1 реагентті төгіп тастап фильтірлік қағазбен заттық шыныны кептіреміз де лотокқа орналастырамыз да 20минут экпозицияда 8-10мл 2 реагентті қосып, реагентті төгіп тастаймыз да дистильденген суда шаямыз. Содан соң горизонтальды жағдайда хаттық шыныны қойып2минуттық экспозицияда 1мл 70% этил спиртін қосамыз да төгіп тастап осы жағдайда процедураны 96%, 100% этил спиртімен қайталаймыз. Заттық әнекшеге 500мкл №1 бояу құйып 2 минут ұстаймыз да жағындыға 1 мл №2 бояуды қосып 10-15 минут ұстап тұрамыз. Жағындыны 7-10 минут ауада кептіріп кептіреміз. Спермилер санын анықтап формула арқылы спермидің протаминмен проценттік көрсеткішін анықтаймыз, гистоны бар жетілген спермилерлер мен жетілмеген спермилер анықталады.
Зерттеу нәтижелері және оларды талқылау. ДНҚ фрагментациясының дәрежесін микроскоппен иммерсиялық май көмегімен 40х көрсеткішімен қараймыз. Спермилерді микроскопиялау кезінде 3 топқа бөліп қарастырамыз: ДНҚ фрагментациясынсыз спермилер ( / ≤1, 4), ДНҚ фрагментациясымен сперми ( / =1-ден 1, 4-ке дейін) және дегенерирленген сперми ( / ≥1, 0) деп бөліп қарастырамыз. (сурет - 2)
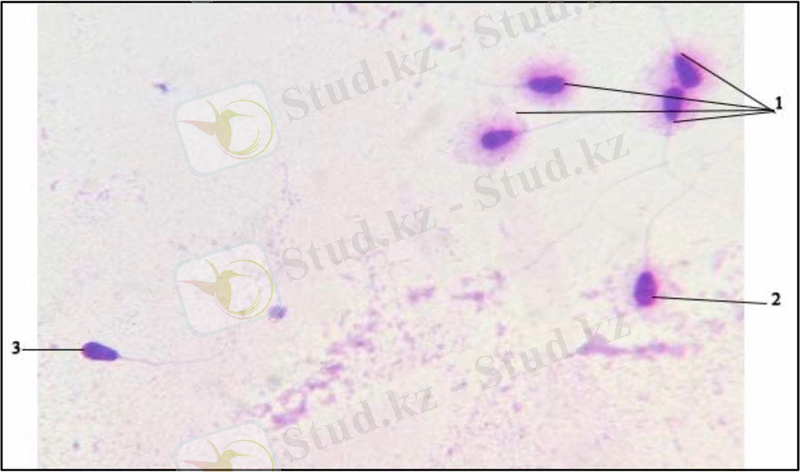
Сурет - 2. 1. фрагментациясынсыз спермилер ( / ≤1, 4), 2. ДНҚ фрагментациясымен сперми ( / =1-ден 1, 4-ке дейін) 3. дегенерирленген сперми ( / ≥1, 0)
2. 4. Спермидегі хроматин жағдайын бағалау. Хроматин доминирлеуші және аяқтаушы мағынаны беретін структура. Ол биологиялық толықтылық сақталуын, ұрықтану орнына жетуін, ондағы ДНҚ-ның болуын қамтаасыз етеді. Хроматин жағдайы геномдардың функциональдық белсенділігімен ондығы жатқан механизмдермен байланысты.
Сперматогенез түзілуі нәтижесі әлі биологиялық жетілмеген және ооцитті ұрықтандыруға қабілетсіз болып келеді. Оның соңғы жетілуі эпидимис каналының қозғалып, пісіп-жетілуімен, түзусызықты-поступатальды ұрықтандыру қозғалысымен аяұталады.
Жетілген спермилер структурасы мен функциясының өзгерісі плазматикалық мембрана, протоплазма және бастысы ядролық материалмен байланысты.
Хроматиннің жалпы санын анықтау. (Фельген реакциясы) . Фельген реакциясын қолдану - классикалық стехиометрлік әдіспен ядро клеткасындағы хроматин қолдану ретінде белгілі. Шифф реакциясының (фуксин мен сернис қышқылының басты комплексі) альгедин тобынағы дезоксирибозы мен байланысты болып, тұз қышқылының гидролизімен, ДНҚ фуксин пупурлік түсті комплекс түзілуінен кейін қол жетімді болды. Боялған материалдың және ДНҚ сперматозиодының алынған нәтижелері толық бағалауға нәтиже береді.
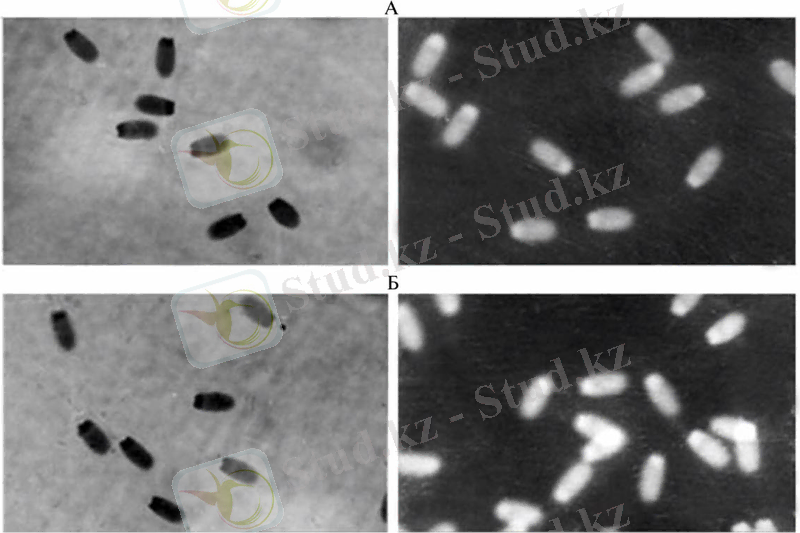
Сурет - 3. Сперматозоидымен Фильген реакциясы. А- жаңа алынған шәует, Б - 6 тәулік бөлме темперетурасында сақталан шәует (қозғалғытығы 0 балл) . Оң және сол жақтағы классикалық және флеуресценттік үлгіге сай.
Классикалық флуресцентті варианттан басқа, Фельген оң флуросцентті комплекс бар (сурет-3) . Бұрынғы Фельген-оң тест материалдары бүұалардың ертильділігін анықтауда теріс нәтиже берді. Фельген-оң материалы сперматазоидта ұрықтағы гамета саны және 6-тәуліктен бөлме темпиратурасында кейін өлген сператозоидтар анықталмады. Ұрық сақталуынан 1 тәуліктен кейін көп клеткалар жаңа алынған ұрық клеткасы ДНҚ - дағыдай, сондай-ақ тірі және ұрықтандыруға қабілетті спермилер қысқарған. 1-3 тәуліктен кейін өлі спермилер ДНҚ саны көбейген. ( қисық Гаусс модасы төменгі мағынаға дейін) . Осындай бұзылған хроматин саны бар спермилер бірден азаяды.
ДНҚ денатурациясы кезінде хроматин тұрақтылығын бағалау. (SCSA - sperm chromatin structure assay) . Аталған әдісті алғаш рет D. P. Evenson ұсынған. Оның негізгі мақсаты денатурация кезінде сперматозоид ДНҚ тұрақтылығын анықтауға негізделген. Изолирленгн ядро клеткасын 5 минут бойы 100°С температурада қыздыып, ДНҚ жүзуін қамтамасыз етеміз. Сарғылт акридин бояуымен бояғаннан кейін алынған жарық құрамында екі спиральдық ДНҚ-сы бар ядро жасыл түсті жаарықпен жанады (ұзындығы 540 нм), ал ядрода ДНҚ-сы денатурацияланған бір спиральды толқын қызыл түске боялады (ұзындығы 600 нм) . Ядролардың ұзындығы микрофлуориметрдің праграммалық есептеуімен, ядролардың денатурацияланған және денатурацияланбаған ДНҚ автоматты түрде есептеуге мүмкіндік береді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz